
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。

试回答:
(1)A中所放试剂为________,B中所放试剂为_____,二者反应的化学方程式为_______。
(2)为得到干燥纯净的氯气,一般在C瓶中加入___试剂,D瓶中加入___试剂。
(3)E中布条颜色为___色; F反应的化学方程式为_______。
(4)H中应加入的试剂为____,其作用是_______。
【答案】浓盐酸 MnO2 MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O 饱和食盐水 浓硫酸 红色 Cu + Cl2
MnCl2 + Cl2↑+ 2H2O 饱和食盐水 浓硫酸 红色 Cu + Cl2 ![]() CuCl2 氢氧化钠溶液 Cl2 +2OH- =Cl- + ClO-+ H2O
CuCl2 氢氧化钠溶液 Cl2 +2OH- =Cl- + ClO-+ H2O
【解析】
实验室利用二氧化锰和浓盐酸加热反应生成氯气,则分液漏斗A中所放试剂是浓盐酸,圆底烧瓶B中所放试剂是二氧化锰固体;C瓶中盛有饱和食盐水,目的是除去氯气中的氯化氢气体;D瓶中试剂为浓硫酸,目的是除去氯气中的水蒸气得到干燥纯净的氯气;氯气无漂白作用,E中干燥的氯气遇到干燥有色布条不褪色;F装置是铜加热和氯气反应生成氯化铜的反应;H中试剂为氢氧化钠溶液,目的是吸收氯气,防止污染空气。
(1)实验室是利用二氧化锰和浓盐酸加热反应生成氯气,分液漏斗A中所放试剂是浓盐酸,圆底烧瓶B中所放试剂是二氧化锰固体,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,故答案为:浓盐酸;二氧化锰;MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,故答案为:浓盐酸;二氧化锰;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)生成的氯气中含有挥发出的氯化氢气体,可用C瓶中饱和食盐水除去氯气中的氯化氢气体, D瓶中试剂为浓硫酸,目的是除去氯气中的水蒸气得到干燥纯净的氯气,故答案为:饱和食盐水;浓硫酸;
(3)E中干燥的氯气遇到干燥有色布条不褪色,说明氯气无漂白作用,F装置是铜加热和氯气反应生成氯化铜的反应,生成的氯化铜形成棕色烟,反应的化学方程式为Cu + Cl2 ![]() CuCl2,故答案为:干燥的红色布条不褪色;产生大量棕黄色烟;Cu + Cl2
CuCl2,故答案为:干燥的红色布条不褪色;产生大量棕黄色烟;Cu + Cl2 ![]() CuCl2;
CuCl2;
(4)氯气有毒,不能排放到空气中,为防止污染空气,需要用氢氧化钠溶液吸收,H中试剂为氢氧化钠溶液,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:氢氧化钠溶液;Cl2+2OH-=Cl-+ClO-+H2O。


科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:

(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______。NH3比PH3的沸点高,原因是_________。
(3)氮元素的第一电离能比同周期相邻元素都大的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为______。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则EMIM+离子中的大π键应表示为________。
),则EMIM+离子中的大π键应表示为________。

(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮、氧、磷、硫、铁,锌、铜等都是组成蛋白质的重要元素。回答下列问题:
(1)Fe的基态原子的核外电子排布式为_________,3d能级上的未成对电子数为____。
(2)在C、N、O、P、S五种元素中,第一电离能最大的元素是_____(填元素符号,下同),电负性最大的元素是______
(3)氨基乙酸(H2NCH2COOH)是蛋白质完全水解的产物之一,其中C原子的杂化轨道类型为______;1molH2NCH2COOH中含有![]() 键的数目为_____NA。
键的数目为_____NA。
(4)蛋白质在体内部分被氧化生成尿素[CO(NH2)2]、二氧化碳、水等排出体外。
①CO2、H2O分子的空间构型分别为_____、_____。
②尿素的熔点为132.7℃,其固体属于_____晶体。
③尿素易溶于水,其原因除都是极性分子外,还有_________。
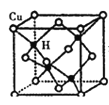
(5)Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为____。若该晶体的密度为ρg·cm—3,阿伏加德罗常数的值为NA,则该晶胞的棱长为_____nm(用含ρ和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。

(1)需称量___g烧碱,应放在_______(填仪器名称)中称量。
(2)配制过程中,不需要的仪器(填写代号)_______。
a、烧杯 b、量筒 c、玻璃棒 d、500mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____。
(4)步骤B通常称为转移,步骤A通常称为________。
(5)将上述实验步骤A到F按实验过程先后次序排列_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:

已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。请回答:
(1)化合物M的组成元素是____(用元素符号表示)。
(2)化合物A与水反应的化学方程式是____。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L酒石酸(用H2T表示)溶液中逐滴滴加等物质的量浓度的NaOH溶液。有关微粒的物质的量与混合溶液的pH有如图关系。下列说法正确的是( )

A. V(NaOH)=10 mL时,溶液中存在c(Na+)=2c(H2T)+2c(HT-)+2c(T2-)
B. V(NaOH)=20mL时,溶液中存在c(Na+)>c(HT-)>c(H+)>c(H2T)>c(T2-)
C. V(NaOH)=30mL时,溶液中存在c(Na+)>c(HT-)>c(T2-)>c(OH-)>c(H+)
D. V(NaOH)=40mL时,溶液中存在c(OH-)=c(HT-)+2c(H2T)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】张青莲是我国著名的化学家,1991年他准确测得In的相对原子质量为114.818,被国际相对原子质量委员会采用为新的标准值。下列说法中,错误的是( )
A. ![]() In是In元素的一种核素 B.
In是In元素的一种核素 B. ![]() In原子核内有49个中子
In原子核内有49个中子
C. ![]() In原子核内质子数和中子数之和为115 D.
In原子核内质子数和中子数之和为115 D. ![]() In原子核外有49个电子
In原子核外有49个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列有关叙述正确的是
A. 标准状况下,铁在22.4L氯气中完全燃烧时转移电子数为3NA
B. 1 L 0.1 mol·L1的NaHCO3溶液中![]() 和
和![]() 离子数之和为0.1NA
离子数之和为0.1NA
C. 在一定温度下64gSO2与足量氧气充分反应,转移电子数为4NA
D. 含有NA个Fe( OH)3胶粒的氢氧化铁胶体中,铁元素的质量大于56g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com