
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
【答案】B
【解析】
室温下,Kw=c(H+)×c(OH-)=10-14,则溶液的pH+pOH=14,由图可得,Q点的pH=pOH,则Q点溶液呈中性,M点溶液呈碱性,N点溶液呈酸性。据此并结合溶液中的守恒关系进行判断。
A项,M点溶液呈碱性,c(OH-)>c(H+),根据电荷守恒可得:c(Cl-)<c(NH4+),故A错误;
B项,N点溶液呈酸性,c(H+)>c(OH-),根据电荷守恒可得:c(NH4+)<c(Cl-),所以可能存在c(NH4+)+c(NH3H2O)=c(Cl-)(当两溶液恰好完全反应时得到氯化铵溶液,氯化铵水解使溶液呈酸性,根据物料守恒可知,此等式成立。),故B正确;
C项,盐酸与氨水恰好中和得到NH4Cl溶液呈酸性,而Q点溶液呈中性,氨水稍过量,故C错误;
D项,氨水中水的电离被抑制,滴加盐酸生成氯化铵,使水的电离程度增大,Q点时溶液呈中性,水的电离既不被抑制也不被促进,所以M点到Q点所示溶液中水的电离程度增大,故D错误。
综上所述,符合题意的选项为B。


科目:高中化学 来源: 题型:
【题目】下列反应中,反应前后溶液颜色不发生变化的是( )
A.乙烯通入酸性高锰酸钾溶液
B.氯气用足量氢氧化钠溶液吸收
C.铁粉投入硫酸铜溶液
D.淀粉和碘化钾混合溶液中通入氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列物质之间的转化能实现的是( )
①C![]() CO2
CO2![]() CO
CO
②Si![]() SiO2
SiO2![]() H2SiO3
H2SiO3
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Mg(OH)2![]() MgCl2(aq)
MgCl2(aq)![]() 无水MgCl2
无水MgCl2
⑤NH3![]() NO
NO![]() NO2
NO2![]() HNO3
HNO3
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周辉《清波杂志》卷十二:信州铅山胆水自山下注,势若瀑布,用以浸铜,铸冶是赖,虽干溢系夫旱涝,大抵盛于春夏,微于秋冬。古传一人至水滨,遗匙钥,翌日得之,已成铜矣。这里的胆水是指
A. CuSO4 溶液 B. FeSO4 溶液 C. 氨水 D. NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500℃和催化剂存在的条件下,某固定容积的容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)。下列有关说法正确的是( )
2SO3(g)(正反应放热)。下列有关说法正确的是( )
A. 达到化学平衡时,混合气体中SO3的质量分数不再变化
B. 在上述条件下,SO2能完全转化为SO3
C. 达到化学平衡时,正反应和逆反应的速率相等且都为零
D. 达到平衡时,SO2和SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,将2mol气体A和1mol气体B充入容积为2L的恒容密闭容器中,发生如下反应:2A(g)+B(g)![]() xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
xC(g),2min时化学反应达到平衡(温度仍为t℃),此时B还有 0.6mol,并测得C的浓度为0.6mol/L。请回答下列问题:
(1)判断该反应达到平衡的标志是______。
a.容器中的压强保持不变 b.A的生成速率与B的消耗速率之比为2:1
c.容器内混合气体的密度保持不变 d.A的百分含量保持不变
e.B和C的物质的量浓度之比为1:x
(2)x=___, 从反应开始到达到平衡时,用B表示该反应的平均反应速率v(B)=____;
(3)化学反应达到平衡时,A的转化率为_____。
(4)某化学兴趣小组同学为了研究上述反应的反应速率,他们将A、B在一定条件下反应并测定反应中生成物C的浓度随反应时间的变化情况,绘制出如图所示的曲线。
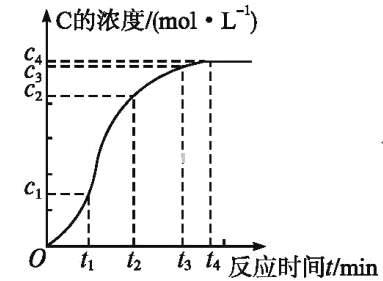
在O~t1、t1~t2、t2~t3各相同的时间段里,反应速率最大的时间段是____,从反应速率的变化可看出该反应可能是____(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知SO2和O2反应生成2molSO3时,放出的热量为QKJ,在1L的密闭容器中进行反应 2SO2(g)+O2(g)![]() 2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
2SO3(g),SO2、O2、SO3的起始物质的量分别为0.2mol、0.1mol、0.2mol,下列叙述正确的是
A. 反应达到平衡时放出的热量为0.1QKJ
B. 某时刻,SO3的物质的量为0.28 mol,则SO2的转化率为40%
C. 某时刻,SO2、O2、SO3的物质的量分别为0.3mol、0.15mol、0.15mol
D. 某时刻,SO3的浓度可能为0.4mol-1·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是中学教材中元素周期表的一部分,其中标出A~R 15种元素,试根据它们回答下列问题(填具体元素符号或化学式):
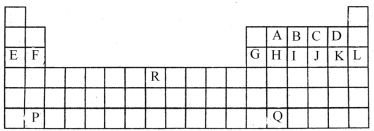
(1)化学性质最不活泼的是____,原子半径最小的是(除稀有气体元素)___属于过渡元素的是____(填A~R中的代号)。
(2)最高价氧化物对应的水化物中酸性最强的是_____,单质中氧化性最强的是________,第三周期元素形成的简单离子中半径最小的是______。
(3)F与K形成的化合物溶于水发生电离,所破坏的化学键为______。
(4)Q在元素周期表中的位置是_____,B、C可形成化合物B2C,该化合物的核外电子总数为_____。
(5)P的最高价氧化物对应的水化物与B的最高价氧化物对应的水化物的离子方程式:____________。
(6)元素E与元素F相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是______(填序号)。
a.与酸反应时,每个F原子比每个E原子失电子数多
b.E的氢化物比F的氢化物稳定
c.E和F的单质与水反应E较剧烈
d.最高价氧化物对应水化物碱性E比F强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关试剂的保存方法,错误的是
A. 浓硝酸保存在棕色试剂瓶中并放置在阴凉处
B. 少量的金属钠保存在煤油中
C. 液溴应保存在棕色细口瓶中,并加水液封
D. 新制的氯水通常保存在无色细口瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com