
 .FeCl3是共价化合物(填“离子”或“共价”).
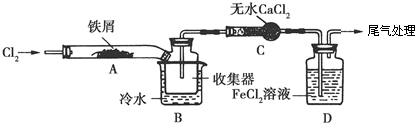
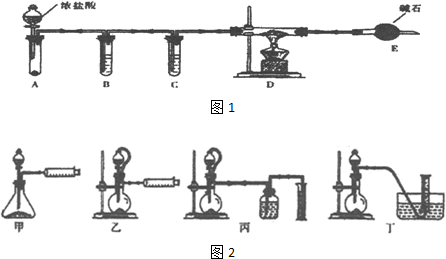
.FeCl3是共价化合物(填“离子”或“共价”).分析 装置A中铁与氯气反应,反应为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3,B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;为防止外界空气中的水蒸气进入装置使FeCl3潮解,所以用装置C无水氯化钙来吸水,装置D中用FeCl2吸收Cl2时的反应离子方程式2Fe2++Cl2═2Fe3++2Cl-,用装置D中的副产品FeCl3溶液吸收H2S,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,用氢氧化钠溶液吸收的是氯气,不用考虑防倒吸,所以装置E为氢氧化钠溶液吸收氯气.
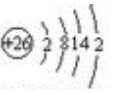
(1)依据铁原子核内有26个质子,核外有4个电子层,从内到外依次容纳2,8,14,2个电子,据此书写原子结构示意图;一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物;
(2)装置A中铁与氯气反应生成氯化铁;
(3)要使沉积的FeCl3进入收集器,根据FeCl3加热易升华的性质;
(4)防止FeCl3潮解,不与水蒸气接触;
(5)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品;装置C的名称为干燥管;Fe[(CN)6]3-中CN-为配离子,则配离子的配位数是6;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应.
解答 解:(1)铁原子核内有26个质子,核外有4个电子层,从内到外依次容纳2,8,14,2个电子,原子结构示意图: ;氯元素的电负性为3.16,铁元素为1.83,相差1.33.规定:一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物. 因此,FeCl3是:共价化合物;
;氯元素的电负性为3.16,铁元素为1.83,相差1.33.规定:一般的,电负性差值超过1.7,为离子化合物,否则为共价化合物. 因此,FeCl3是:共价化合物;
故答案为: ;共价;
;共价;
(2)铁与氯气反应生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(3)第③步加热后,生成的烟状FeCl3大部分进入收集器,第④步操作是对FeCl3加热发生升华使沉积的FeCl3进入收集器,
故答案为:在沉积的FeCl3固体下方加热;
(4)为防止FeCl3潮解所采取的措施有②通入干燥的Cl2⑤用干燥的N2赶尽Cl2,
故选:②⑤;
(5)B中的冷水作用为是冷却FeCl3使其沉积,便于收集产品,装置C的名称为干燥管;Fe[(CN)6]3-中CN-为配离子,则配离子的配位数是6;
故答案为:冷却,使FeCl3沉积,便于收集产品;干燥管;6;CN-;
(6)三价铁具有氧化性,硫化氢具有还原性,二者之间发生氧化还原反应:2FeCl3+3H2S=2FeCl2+6HCl+3S↓,离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:2Fe3++H2S=2Fe2++S↓+2H+.
点评 本题考查了制备无水FeCl3实验操作和实验设计,题目难度中等,侧重考查铁、氯、硫及其化合物的性质应用、实验基本操作的分析判断、实验现象的推断和应用,试题综合性较强,有利于培养学生灵活应用基础知识的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
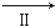 FeCl3•6H2O晶体
FeCl3•6H2O晶体查看答案和解析>>
科目:高中化学 来源: 题型:解答题
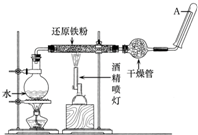 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应.应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
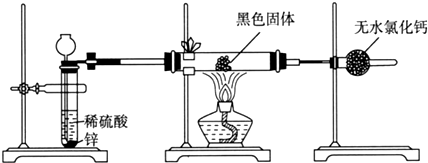
| Fe3O4 | Fe2O3 | Fe | |
| 分解温度/°C | 1538 | 1400 | - |
| 熔点/°C | - | - | 1535 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2>Fe2+>I2 | B. | Cl2>I2>Fe3+ | C. | Cl2>Fe3+>I2 | D. | Fe2+>Cl2>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com