解答:解:有A、B、C、D、E五种短周期元素,B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B
-离子为Cl
-离子,A
+比B
-少一个电子层,A
+为Na
+离子,A为Na元素;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns
2np
3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,故D为S元素,E元素的基态原子核外有六种运动状态的电子,即核外电子数为6,故E为C元素,
(1)A元素的简单离子为Na
+,基态时的电子排布式为1s
22s
22p
6,
R是由N元素与氢元素两种元素形成的18电子分子,R为N
2H
4,电子式为

,
故答案为:1s
22s
22p
6;

;
(2)CB
3分子为NCl
3,分子中N原子成3个N-Cl键,含有1对孤对电子,杂化轨道数目为4,为三角锥型,N原子采取sp
3杂化,
故答案为:三角锥型;sp
3;
(3)D、E、C三元素形成共价化合物为(SCN)
2,分子中各原子均达8电子稳定结构,结构简式为N≡C-S-S-C≡N,
故每个分子中含5个δ键,故答案为:5;
(4)E的一种低价氧化物CO与充入二氧化碳的空气和熔融碳酸钾可构成燃料电池,原电池负极发生氧化反应,CO在负极通入,CO被氧化,在熔融碳酸钾中生成CO
2,电极反应式为:CO+CO
32--2e
-=2CO
2,正极发生还原反应,氧气再正极通入,二氧化碳参与的反应生成CO
32-,电极反应式为:O
2+2CO
2+4e
-=2CO
32-,
故答案为:CO+CO
32--2e
-=2CO
2;O
2+2CO
2+4e
-=2CO
32-;
(5)1.2g碳的物质的量为
=0.1mol,标准状况下的1.68L氧气的物质的量为
=0.075mol,所以n(C):n(O)=0.1mol:0.075mol×2=1:1.5,故燃烧生成物为CO、CO
2,令CO、CO
2的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.1,根据O原子守恒有x+2y=0.075×2,联立方程,解得x=0.05,y=0.05,碳的燃烧热为Y KJ/mol,故生成0.05molCO
2放出的热量为0.05mol×Y kJ/mol=0.05YkJ,故生成0.05molCO放出的热量为X kJ-0.05YkJ=(X-0.05Y)kJ,故1mol碳燃烧生成CO放出的热量为(X-0.05Y)kJ×
=(20X-Y)kJ,故1mol碳与O
2反应生成CO时的热化学方程式为:C(s)+
O
2(g)=CO(g)△H=-(20X-Y)kJ/mol,
故答案为:C(s)+
O
2(g)=CO(g)△H=-(20X-Y)kJ/mol.



 ,
, ;
;

 53天天练系列答案
53天天练系列答案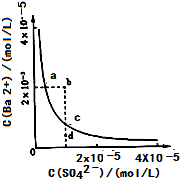 (2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
(2013?达州模拟)难溶物BaSO4在水中的溶解平衡可表示为:BaSO4(s)?Ba2+(aq)+SO42-(aq).其溶度积常数Ksp=C(Ba2+)?C(SO42-),某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )