
| |||||||||||||||||||||||||||||||
(1) |
因最外层电子不多于8个,A元素的次外层电子只能是2个,故最外层电子是6个,则A为O元素.B元素原子的次外层电子数是最外层电子数的2倍,B可能是Li元素或Si元素. |
(2) |
|
(3) |
答案:原子具有114个质子,114个电子,七个电子层,最外层电子数为4.位于第7周期、第ⅣA族,具有+2和+4两个正化合价,元素的金属性较强.单质还原性较强,氧化物化学式为MO和MO2,氧化物的水化物的化学式为M(OH)2和M(OH)4,元素有放射性. 解析:第7周期的稀有气体元素的原子序数是118,因此114号元素一定位于第7周期内.根据自右向左各族排列的规则,可确定114号元素位于第ⅣA族,应该具有+2、+4两个正化合价,氧化物化学式为MO和MO2,氧化物的水化物的化学式为M(OH)2和M(OH)4.自87号Fr元素开始的元素都具有放射性,则114号元素也应该具有放射性. |


科目:高中化学 来源:高中化学新课标鲁科版 必修Ⅱ 鲁科版 题型:043
1871年,门捷列夫预言:一定存在一种元素,在元素周期表中它紧排在锌的后面,处于铝和铟之间.他将其称为“类铝”,并预测了它的性质.四年后,法国化学家布瓦博德朗发现了它——镓(Ga),并通过实验证实了门捷列夫的预测.当你看到这个资料后,你是否联想到,门捷列夫是怎样如此准确地预测的?对化学元素及其性质的预测需要具备和掌握运用哪些规律和知识?是不是应该是“元素性质之间的一种内在联系”?这种联系是什么?为什么有这种联系?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)A元素原子最外层电子数是次外层电子数的3倍,B元素原子次外层原子数是最外层电子数的2倍,则A、B元素( )
A.一定是第2周期元素 B.一定是同一主族元素
C.可能是第2、3周期元素 D.可以相互化合形成化合物
(2)某元素X的核外电子数等于核内中子数,取该元素单质
A.第3周期 B.第2周期 C.第ⅣA族 D.第ⅤA族
(3)根据原子结构理论和元素周期律,请预测原子序数为114的元素(此元素尚未命名,暂用M表示其元素符号)的有关知识。(在周期表中的位置、原子结构、构成氧化物和对应水化物的化学式、放射性等)
查看答案和解析>>
科目:高中化学 来源:北京期中题 题型:填空题
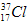 的中子数为______,该氯原子与
的中子数为______,该氯原子与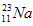 原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
原子形成的化合物的摩尔质量为________,用电子式表示该化合物的形成过程 ______________________。
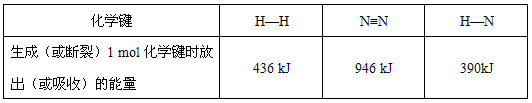
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com