
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
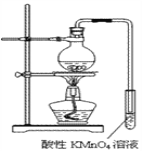
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)实验原理:__________________________________。
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:_________________________。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:______________________________________________________。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______________________________。
(5)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
①________________________。②___________________________。
【答案】 ![]() 乙醇易挥发,挥发出的乙醇也可以使酸性KMnO4溶液褪色 在小试管之前增加一个盛有冷水的洗气瓶 反应温度较低 冷凝管(或用较长的导气管) 量程为200℃的温度计
乙醇易挥发,挥发出的乙醇也可以使酸性KMnO4溶液褪色 在小试管之前增加一个盛有冷水的洗气瓶 反应温度较低 冷凝管(或用较长的导气管) 量程为200℃的温度计
【解析】(1)实验原理用化学方程式可表示为:![]() 。
。
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,原因是乙醇易挥发,挥发出的乙醇也可以使酸性KMnO4溶液褪色。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法是利用乙醇易溶于水,在小试管之前增加一个盛有冷水的洗气瓶。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是反应温度较低。
(5)结合资料二、三,应该在实验装置中增加冷凝回流装置以和控制温度的仪器,以减少溴乙烷的挥发和控制反应温度,所以还需要的两种仪器是①冷凝管(或用较长的导气管);②量程为200℃的温度计。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】向一体积为2L的恒温恒容密闭容器中充入一定量的H2和N2,发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
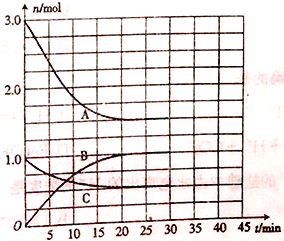
(1)表示N2浓度变化的曲线是________(填“A”“ B”或“C”),25min时,c(NH3)= ______。
(2)0~20min内,v(H2)= ______。若该过程中反应放出的热量为47.2kJ,则a=______。
(3)30min时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率______(填“增大”“ 减小”或“不变”,下同),逆反应速率_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C的结构简式如下:
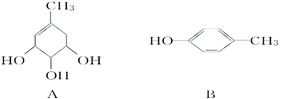
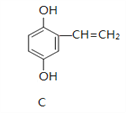
(1)A分子中含有的官能团的名称是_____________________;
(2)能与NaOH溶液反应的是_________(填“A”、“B”或“C”),写出与NaOH溶液反应的化学方程式_________________________________________。(任写一个)
(3)A在浓硫酸作用下加热可得到B,其反应类型是_________________。
(4)1 molC分别与浓溴水和H2反应时,最多消耗Br2 _____ mol、消耗H2 ____ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1L 10mol/L NaOH溶液吸收0.8molCO2,所得溶液中CO32–和HCO3–的物质的量浓度之比是
A. 1 : 3 B. 2 : 1 C. 2 : 3 D. 3 : 2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钾(KCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3=4N2↑+2HNO3+9H2O则被氧化和被还原的氮元素质量之比为________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。若8molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)处理CN一常用的一种方法是用氯气氧化。若某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 = KOCN+2KCl+H2O 。若投入过量液氯,可将氰酸盐进一步氧化为无毒的N2和CO2。请写出该反应的化学方程式,____,若处理上述废水20 L,使KCN完全转化为无毒物质,至少需液氯_________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应2H2S+O2=2S↓+2H2O,4NaI+O2+2H2O=4NaOH+2I2和Na2S+I2=2NaI+S↓,下列氧化性大小关系正确的是
A. O2>I2>S B. I2>O2>S C. O2>S>I2 D. S>I2>O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸“Na—CO2"电池。放电时该电池“吸入” CO2,充电时“呼出” CO2。吸入CO2时,其工作原理如右图所示。吸收的全部CO2中,有 2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A. “吸入” CO2时的正极反应:4Na++ 3 CO2+ 4e -= 2Na2CO3+ C
B. “呼出” CO2时,Na+向多壁碳纳米管电极移动
C. “吸入” CO2时,钠箔为正极
D. 标准状况下,每“呼出”22.4 L CO2,转移电子数为0.75 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
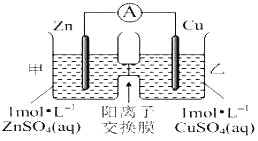
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com