
【题目】向一体积为2L的恒温恒容密闭容器中充入一定量的H2和N2,发生反应:N2(g)+ 3H2(g) ![]() 2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
2NH3(g) △H=a kJmol-1。体系中气体的物质的量随时间的变化如图所示。
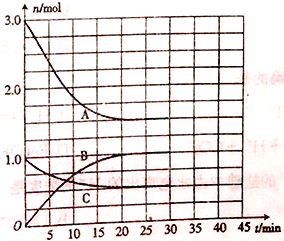
(1)表示N2浓度变化的曲线是________(填“A”“ B”或“C”),25min时,c(NH3)= ______。
(2)0~20min内,v(H2)= ______。若该过程中反应放出的热量为47.2kJ,则a=______。
(3)30min时,向容器中再充入一定量的NH3,一段时间后,与原化学平衡状态时的反应速率相比,正反应速率______(填“增大”“ 减小”或“不变”,下同),逆反应速率_______________。
【答案】 C 0.5mol·L-1 0.0375mol·L-1·.min-1 -94.4 增大 增大
【解析】本题考查化学反应速率计算、影响化学反应速率的因素,(1)根据题中信息,N2是反应物,其浓度应是减小,应从A和C选择,化学反应速率之比等于化学计量数之比,v(N2)=1/3v(H2),因此表示N2浓度变化的曲线是C,表示NH3的曲线是B,根据图像,20min时达到平衡,即NH3的浓度为1.0/2mol·L-1=0.5mol·L-1;(2)根据上述分析,A曲线代表H2的变化,0-20min时,消耗氢气物质的量为(3-1.5)mol=1.5mol,根据化学反应速率数学表达式,v(H2)=1.5/(2×20)mol/(L·min)=0.0375 mol/(L·min),此反应是放热反应,消耗3mol氢气,放出的热量47.2×3/1.5kJ=94.4kJ,因此a=-94.4;(3)30min时,再充入一定量的氨气,相当于在原来的基础上增大压强,增大压强,反应速率加快,即正逆反应速率都增大。


科目:高中化学 来源: 题型:
【题目】下列指定化学反应的离子方程式正确的是
A. 二氧化锰和浓盐酸共热: MnO2 +4HCl![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
B. AlCl3溶液中滴加过量的浓氨水:Al3++4NH3·H2O=AlO![]() +4NH4++2H2O
+4NH4++2H2O
C. 将Cu2O与稀HNO3混合:3Cu2O+14H++2NO![]() ===6Cu2++2NO↑+7H2O
===6Cu2++2NO↑+7H2O
D. 向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X是一种晶体,在一定条件下可发生如图所示的变化。下列叙述正确的是

①X可能是铝或硅 ②X可能是原子晶体或金属晶体
③W一定是两性物质 ④W晶体的熔点很高
A. ①②③ B. ①②④ C. 只有③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法错误的是( )
A.磁性氧化铁可用作红色油漆和涂料
B.漂白粉可用于生活用水的消毒
C.氢氧化铝可用于中和过多胃酸
D.硅胶可用作袋装食品的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。
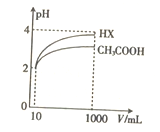
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数。下列叙述中正确的是( )
A.标准状况下,2.24L水中含H原子的数目为0.2NA
B.1L 0.1 mol·L-1KNO3溶液里含O原子的数目为0.3NA
C.2.3g钠反应生成Na2O和Na2O2的混合物,转移电子的数目为0.1NA
D.1mol H3O+和1molNH4+中含质子的数目均为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中能大量共存的一组离子是( )
A. Al3+、Na+、OH-、SO42- B. H+、NH4+、CH3COO-、SO42-
C. Na+、Ca2+、Cl-、CO32- D. K+、Ba2+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组探究溴乙烷的消去反应并验证产物。
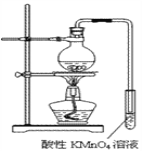
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象。一段时间后,观察到酸性KMnO4溶液颜色褪去。
(1)实验原理:__________________________________。
(2)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:_________________________。
(3)丙同学认为只要对实验装置进行适当改进,即可避免对乙烯气体检验的干扰,改进方法:______________________________________________________。
改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显。该小组再次查阅资料,对实验进行进一步的改进。
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%。
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快。
资料三:溴乙烷的沸点:38.2℃。
(4)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是_______________________________。
(5)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是
①________________________。②___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com