
【题目】常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。下列说法不正确的是
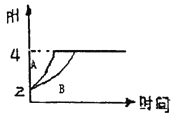
A. 图中表示醋酸溶液中pH变化曲线的是B
B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,则m1<m2
C. pH=2时盐酸和醋酸的物质的量前者小
D. pH=4时两溶液c(Zn2+)相等
【答案】D
【解析】A、反应过程中醋酸电离出氢离子,所以反应过程中醋酸中c(H+)大于HCl,pH小,图中表示醋酸溶液中pH变化曲线的是B,故A正确;B. 设盐酸和醋酸中加入的Zn质量分别为m1、m2,醋酸中消耗n(H+)大于盐酸,消耗氢离子的物质的量与消耗锌的质量成正比,所以消耗锌的质量m1<m2,则m1<m2,故B正确;C.醋酸是弱电解质,难电离, pH=2时盐酸和醋酸的物质的量前者小,故C正确;D、根据电荷守恒:2c(Zn2+)+c(H+) =c(Cl-)+c(OH-),2c(Zn2+)+c(H+) =c(CH3COO-)+c(OH-),pH=4时,两溶液中c(Cl-)和c(CH3COO-)不相等,两溶液c(Zn2+)不相等,故D错误;故选D。


科目:高中化学 来源: 题型:
【题目】如图是恒温下某化学反应的反应速率随反应时间变化的示意图.下列叙述与示意图不相符合的是( ) 
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡状态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡状态Ⅱ
C.该反应达到平衡状态Ⅰ后,减小反应物浓度,平衡发生移动,达到平衡状态Ⅱ
D.同一种反应物在平衡状态Ⅰ和平衡状态Ⅱ时浓度不相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下反应:X(g)+Y(g) ![]() Z(g)+W(s), △H>0下列叙述正确的是( )
Z(g)+W(s), △H>0下列叙述正确的是( )
A. 加入少量W,逆反应速度增大 B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡逆向移动 D. 平衡后加入X,上述反应的△H增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类法的作用几乎是无可替代的.如图为一“链状连环”图案,图案上由左到右分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分由左到右A、B、C、D为其相应的分类依据代号.
请回答下列问题:
(1)请将分类依据代号填入相应的括号内.
两种物质都不是电解质
两种物质都是钠的化合物
两种物质都是氧化物
两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入1molL﹣1的上图中一种化合物的水溶液,可制得一种红色胶体.
①反应的化学方程式为 .
②如何用较简单的方法判断胶体是否制备成功? .
③向该胶体中逐滴加入HI稀溶液,会出现一系列变化:
a.先出现红褐色沉淀,原因是 .
b.随后红褐色沉淀溶解,此反应的离子方程式是 . ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“稀土之父“徐光宪在《化学分子共和国》中介绍了许多物质,下列有关说法不正确的是
A. 固态CO2 俗称干冰,大量排放易造成温室效应
B. 碘单质“望酸碱而逃”指:碘单质遇碱歧化为I-和IO3-,再遇酸归中成碘单质
C. CO会引起煤气中毒,冬天用煤进行取暖时,在屋内放置一盆水,就可以有效防止中毒
D. NO自述“诞生在闪电的弧光中,强大的能量造就了我”指:高压放电情况下,N2和O2生成NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如下图所示,由图中数据分析: 
(1)该反应的化学方程式为:
(2)反应开始至2min,用Z表示的平均反应速率为
(3)下列叙述能说明上述反应达到化学平衡状态的是(填序号)
A.混合气体的总物质的量不随时间的变化而变化
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗3mol X,同时生成2mol Z
D.混合气体的总质量不随时间的变化而变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氧水(H2O2)和水都是极弱的电解质,但H2O2 溶液显弱酸性。把H2O2 看成二元弱酸,则下列化学方程式不正确的是
A. H2O2 在水中电离的离子方程式:H2O2![]() H++HO2-
H++HO2-
B. 少量Na2O2与稀盐酸反应的离子方程式:O22-+2H+==H2O2
C. H2O2 稀溶液与Ba(OH)2稀溶被反应生成正盐的化学方程式:H2O2 +Ba(OH)2=BaO2+2H2O
D. H2O2 稀溶液与Ba(OH)2 稀溶液反应生成酸式盐的化学方程:2H2O2 +Ba(OH)2=Ba(HO2)2+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上合成氨的反应原理为:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92.4 KJ/mol
2NH3(g) ΔH=-92.4 KJ/mol
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将______(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c(H2)将_______。
(2)下图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3时,平衡混合物中氨的体积分数。若分别用VA(NH3)和VB(NH3)表示从反应开始至达平衡状态A、B时的化学反应速率,则VA(NH3)_____VB(NH3)(填“>、“<”或“=")
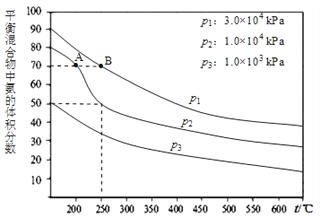
(3)①若恒温恒压下,在一容积可变的容器中,达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡____移动(“向正向“向逆向”“不”);
②若氮气与氢气以1:1混合反应时,达到平衡后,如果升高温度氮气的体积分数将____(“变大”“变小”不变”下同);如果增大压强氮气的体积分数将___。
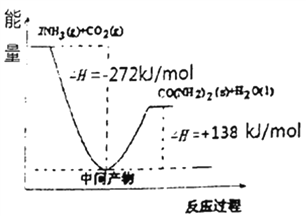
(4)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示:用CO2和氨合成尿素的热化学方程式为________。
(5)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com