
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
【答案】D
【解析】
A.容器I中的反应
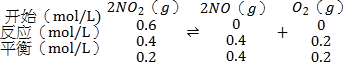
化学平衡常数K=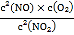 =
=![]() =0.8;
=0.8;
容器II中开始时浓度商Qc=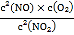 =
=![]() =
=![]() <0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
<0.8,则反应正向进行,平衡时混合气体的物质的量浓度之和大于1mol/L,所以达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比小于0.8mol/L:1mol/L=4:5,故A错误;
B.容器I中反应平衡时c(O2)=c(NO2),如果容器II中平衡时 c(NO2)=c(O2),设参加反应的 c(NO2)=xmol/L,则0.3-x=0.2+0.5x,解得x=![]() ,平衡时 c(NO2)=c(O2)=
,平衡时 c(NO2)=c(O2)=![]() mol/L,c(NO)=0.5mol/L+
mol/L,c(NO)=0.5mol/L+![]() mol/L=
mol/L=![]() mol/L,II中Qc=
mol/L,II中Qc=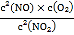 =
=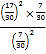 ≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中
≈1.4>0.8,说明II中平衡时应该存在 c(NO2)>c(O2),即容器Ⅱ中 ![]() <1,而容器I中
<1,而容器I中 ![]() =1,所以达平衡时,容器Ⅱ中
=1,所以达平衡时,容器Ⅱ中 ![]() 比容器Ⅰ中的小,故B错误;
比容器Ⅰ中的小,故B错误;
C.若容器Ⅲ在某时刻,NO的体积分数为50%,可得反应的三段式:
2NO2(g)2NO(g)+O2(g)
起始量(mol/L) 0 0.5 0.35
变化量(mol/L) 2y 2y y
平衡量(mol/L) 2y 0.5-2y 0.35-y
若0.5-2y=2y+0.35-y,解得y=0.05,求出此时浓度商Qc=![]() =4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
=4.8>K,说明此时反应未达平衡,反应继续向逆反应方向进行,NO进一步减少,平衡时NO的体积分数小于50%,故C错误;
D.υ正=υ(NO2 )消耗=k正c2(NO2 ),υ逆=υ(NO)消耗=2υ(O2 )消耗=k逆c2 (NO)c(O2 ),达到平衡状态时正逆反应速率相等,则k正c2(NO2 )=k逆c (NO)c(O2 ),T2时若k正=k逆,则c2(NO2 )=c2 (NO)c(O2 ),化学平衡常数K=1>0.8,该反应的正反应是吸热反应,升高温度平衡正向移动,化学平衡常数增大,则T2>T1,故D正确;
故答案为D。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是![]()
A.将稀氨水逐滴加入稀硫酸中,当溶液的![]() 时,
时,![]()
B.两种醋酸溶液的物质的量浓度分别为![]() 和
和![]() ,pH分别为a和
,pH分别为a和![]() ,则
,则![]()
C.![]() 的NaOH溶液与
的NaOH溶液与![]() 的醋酸溶液等体积混合,滴入石蕊溶液呈红色
的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向![]() 的氨水中加入少量硫酸铵固体,则溶液中
的氨水中加入少量硫酸铵固体,则溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
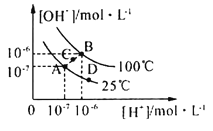
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:![]() 在恒容容器中进行,达到平衡状态的标志是( )
在恒容容器中进行,达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 、
、![]() 、
、![]() 的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
的物质的量浓度变化表示的反应速率之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A.①④⑥B.②③⑤C.①③④D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
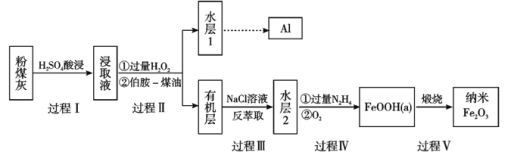
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
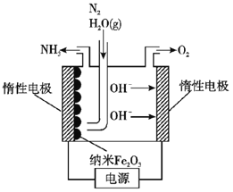
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有可逆反应:![]() ;
;![]() 处于平衡状态
处于平衡状态![]() 已知
已知![]() ,则下列说法正确的是
,则下列说法正确的是![]()
①升温时![]() 的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
A.③④B.①②⑤C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com