
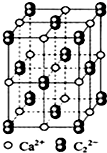
 CaC2可用于固氮:CaC2+N2
CaC2可用于固氮:CaC2+N2
| ||
| 4+0×3+2 |
| 2 |
| 1 |
| 4 |
| m |
| V |
| 4×84 |
| (a×10-7)3 |
| 336 |
| a3×10-21 |
| 4+0×3+2 |
| 2 |
| 1 |
| 4 |
| m |
| V |
| 4×84 |
| (a×10-7)3 |
| 336 |
| a3×10-21 |
| 336 |
| a3×10-21 |


科目:高中化学 来源: 题型:
A、相同条件下,结合质子的能力:OH->AlO2->CO32->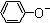 >HCO3->CH3COO- >HCO3->CH3COO- |
B、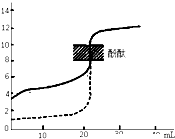 如图表示用0.1mol/LNaOH溶液分别滴定相同物质的量浓度和相同体积的盐酸和醋酸,其中实线表示的是滴定盐酸的曲线 |
| C、一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率,平衡常数保持不变 |
| D、恒容密闭容器中进行的反应A(g)?B(g)+C(g),在其它条件不变情况下,再充入一定量的A气体,A的转化率将增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
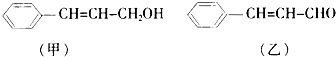
| HCl |
| △ |
| O2/Cu |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该合金中nCu:nMg=2:1 |
| B、合金完全溶解时,溶液中C(H+)=8mol/L(忽略反应前后溶液体积变化) |
| C、NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D、得到2.54g沉淀时,加入NaOH溶液的体积是600mL. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.6 g |
| B、7 g |
| C、2.8 g |
| D、8.4 g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验目的或结论 |
| A | 用激光笔照射某有色玻璃 | 出现丁达尔现象,说明该有色玻璃是胶体 |
| B | 向混有乙酸和乙醇的乙酸乙酯的混合物中,加入饱和NaOH溶液洗涤、分液 | 得到较纯净的乙酸乙酯 |
| C | 向裂化汽油中加入酸性高锰酸钾溶液,振荡,紫色褪去 | 说明汽油中含有甲苯等苯的同系物 |
| D | AgCl饱和溶液中加入少量NaI溶液 | 产生黄色沉淀,说明Ksp(AgI)<Ksp(AgCl) |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发皿可用来研磨块状固体物质 |
| B、锥形瓶作为反应容器时一定不能加热 |
| C、分液漏斗不宜盛装碱性溶液 |
| D、可用湿润的蓝色石蕊试纸检测氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 分离沸点相差较大的互溶液体混合物 |
B、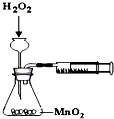 测定化学反应速率 |
C、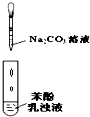 比较苯酚、碳酸的酸性强弱 |
D、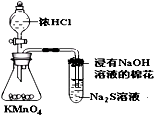 比较KMnO4、Cl2、S的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| x |
| 3 |
| x |
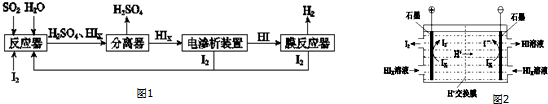
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com