
【题目】原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,X与Z、Y与P分别位于同主族,Z与Y可形成原子个数比分别为1∶1和2∶1的离子化合物。则下列说法正确的是![]()
A. 简单氢化物的沸点:Q>Y
B. 简单氢化物的热稳定性:Y>Q>P
C. 非金属性强弱:Q>P>Y>X
D. X、Y、Z、P形成的化合物的水溶液显碱性
【答案】B
【解析】
原子序数依次增大的五种短周期主族元素X、Y、Z、P、Q分别位于三个周期,Z与Y可形成原子个数比分别为1∶1和2∶1的离子化合物,为Na2O、Na2O2两种常见的离子化合物,则Y为O,Z为Na,X与Z、Y与P分别位于同主族,则X为H,P为S,Q只能为Cl,据此分析解答。
由上述分析可知,X为H,Y为O,Z为Na,P为S,Q为Cl。
A.水分子间能够形成氢键,沸点高于氯化氢,故A错误;
B.非金属性Y>Q>P ,简单氢化物的热稳定性:Y>Q>P ,故B正确;
C.同一周期,从左向右,非金属性增强,同一主族,从上到下,非金属性减弱,非金属性:Y>Q,故C错误;
D.X、Y、Z、P形成的化合物为硫酸氢钠或亚硫酸氢钠,均电离显酸性,故D错误;
答案选B。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】为了更简便制取干燥NH3,下列方法中适合的是( )
A.NH4Cl与H2SO4(浓)混合加热,生成的气体用碱石灰进行干燥
B.N2+3H2![]() 2NH3,用烧碱干燥
2NH3,用烧碱干燥
C.加热浓氨水,气体用碱石灰干燥
D.加热NH4Cl用P2O5干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
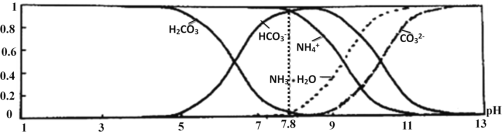
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应的反应过程中能量变化如图所示。下列叙述不正确的是( )
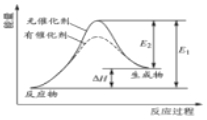
A.该反应的能量变化与氯化铵晶体和氢氧化钡晶体反应相同
B.该反应的△H=E1E2
C.若生成物中某一物质由气态变成液态,则该反应的△H变大
D.加入催化剂可以同时降低E1、E2,但不改变反应的△H
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】植物在冬季来临过程中,随着气温的逐渐降低,体内发生了一系列适应低温的生理生化变化,抗寒力逐渐增强。下图为冬小麦在不同时期含水量和呼吸速率变化关系图。请根据图推断以下有关说法中,错误的是( )

A. 冬季来临过程中,自由水明显减少是呼吸速率下降的主要原因
B. 结合水与自由水含量的比值,与植物的抗寒性呈现明显的正相关
C. 随着气温和土壤温度的下降,根系的吸水量减少,组织的含水量下降
D. 随温度的缓慢降低,植物的呼吸作用逐渐减弱,有利于减少有机物的消耗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃饱和NaCl溶液密度为ρg·cm-3,物质的量浓度为c mol·L-1,则下列说法中不正确的是( )
A.温度低于20℃时,饱和NaCl溶液的浓度小于![]()
B.此溶液中NaCl的质量分数为![]()
C.20℃时,密度小于![]() 的NaCl溶液是不饱和溶液
的NaCl溶液是不饱和溶液
D.20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述不正确的是
A. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
B. 与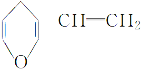 互为同分异构体的芳香化合物有6种
互为同分异构体的芳香化合物有6种
C. 青蒿素 ![]() 的一氯取代物有(不含立体异构)有7种
的一氯取代物有(不含立体异构)有7种
D. 菲的结构简式为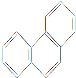 ,它与硝酸反应,可生成5种一硝基取代物
,它与硝酸反应,可生成5种一硝基取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见下图,电池总反应可表示为2H2+O2==2H2O,下列有关说法正确的是()
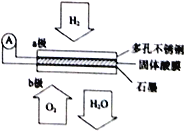
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为:O2+2H2O+4e-=4OH-
C. 每转移0.1 mol电子,便消耗1.12 升的H2
D. H+由a极通过固体酸电解质传递到b极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com