

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
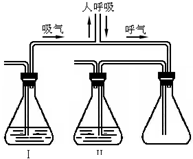 某化学兴趣小组为了证明人呼出的气体中含有CO2,设计了如图所示的实验装置.你认为锥形瓶Ⅰ、Ⅱ中应选用的一组试剂是( )
某化学兴趣小组为了证明人呼出的气体中含有CO2,设计了如图所示的实验装置.你认为锥形瓶Ⅰ、Ⅱ中应选用的一组试剂是( )| A. | B. | C. | D. | |
| 瓶Ⅰ | KOH | NaOH | 稀HCl | Na2SO4 |
| 瓶Ⅱ | NaOH | Ca(OH)2 | AgNO3 | BaCl2 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
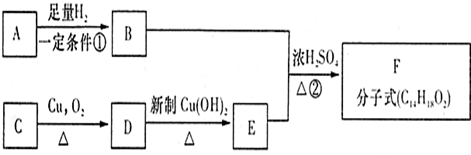
科目:高中化学 来源: 题型:
| NaOH溶液 | 银氨溶液 | 新制Cu(OH)2 | 金属钠 | |
| A | 中和反应 | 溶 解 | 产生氢气 | |
| B | 有银镜 | 加热后有红色沉淀 | 产生氢气 | |
| C | 水解反应 | 有银镜 | 加热后有红色沉淀 | |
| D | 水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图为某有机物的结构简式,则等物质的量的该物质分别与Na,NaOH,NaHCO3反应是消耗的物质的量之比是( )
如图为某有机物的结构简式,则等物质的量的该物质分别与Na,NaOH,NaHCO3反应是消耗的物质的量之比是( )| A、4:2:1 |
| B、3:2:1 |
| C、1:1:1 |
| D、1:2:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
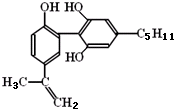
| A、该分子中所有碳原子可以稳定的共存在一个平面中 |
| B、1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol |
| C、遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 |
| D、滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=6的溶液 |
| B、某温度下,c(H+)=c(OH-)=1.0×10-6mol/L的溶液 |
| C、c(H+)>c(OH-) 的溶液 |
| D、常温下,由水电离出的c(H+)=10-13mol/L的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com