
【题目】紫菜与海带类似,是一种富含生物碘的海洋植物。商品紫菜轻薄松脆、比海带更易被焙烧成灰实验室里从紫菜中提取碘的流程如下图:
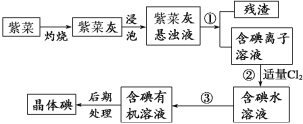
(1)实验室焙烧紫菜,需要下列仪器中的___________(填序号)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①____________,③______________。
(3)提取碘的过程中,可选择的有机试剂是( )
A.酒精 B.苯 C.乙酸 D.食盐水
选择该试剂的理由是_________________________。
(4)为使紫菜灰中碘离子转化为碘的有机溶液,实验室有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品,尚缺少的玻璃仪器有______________、________________。
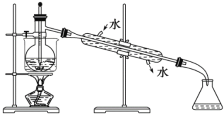
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,观察上面实验装置图改正其中的错误之处:
①_____________________________;
②_____________________________;
③_____________________________。
(6)进行上述蒸馏操作时,使用水浴加热,最后晶态碘在 里聚集。
【答案】
(1)cdef(2)过滤;萃取
(3)B;碘在苯中的溶解度比在水中大得多,苯与水互不相溶
(4)分液漏斗;锥形瓶
(5)①垫石棉网;②温度计水银球应在支管口处;③冷凝管中水下进上出。
(6)蒸馏烧瓶
【解析】
试题分析:实验室从紫菜中提取碘:紫菜焙烧成灰,浸泡溶解得到紫菜灰悬浊液,含有碘离子,加入酸和氧化剂,足量的稀硫酸和双氧水将碘离子氧化成碘单质,通过操作①过滤,得到不溶的残渣,滤液为碘单质溶液,利用有机溶剂A四氯化碳萃取出碘单质,再通过蒸馏提取出碘单质。
(1)焙烧紫菜时用坩埚盛放紫菜,用带铁圈的铁架台放置泥三角,泥三角上放置坩埚,用酒精灯进行加热,所以焙烧紫菜时需要用到的实验仪器是坩埚、带铁圈的铁架台、酒精灯、泥三角,故选:cdef;
(2)分离固体和液体用过滤,③将碘水中的碘单质萃取出来,选择合适的萃取剂即可,故答案为:过滤;萃取;
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳或苯,故答案为:B;碘在苯中的溶解度比在水中大得多,苯与水互不相溶;
(4)海藻灰中碘离子转化为碘的有机溶液,需要用到分液,分液需要用到分液漏斗、锥形瓶,故答案为:分液漏斗;锥形瓶;
(5)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平,故答案为:垫石棉网;温度计水银球应在支管口处;冷凝管中冷却水应下口进上口出;
(6)四氯化碳沸点:76.8℃,碘单质沸点为184℃,所以最后晶态碘在蒸馏烧瓶里聚集,故答案为:蒸馏烧瓶。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】a g铁粉与含有H2SO4的CuSO4溶液完全反应后,得到a g铜,则参与反应的CuSO4与H2SO4的物质的量之比为
A.1:7 B.7:1 C.7:8 D.8:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A. 甲的分子数比乙的分子数多
B. 甲的物质的量比乙的物质的量小
C. 甲的气体摩尔体积比乙的气体摩尔体积小
D. 甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由氧化铜、氧化铁组成的混合物a g,加入2mol·L-1的硫酸50mL时固体恰好完全溶解。若将a g该混合物在足量的一氧化碳中加热充分反应,冷却后固体质量为
A.1.6g B.(a-1.6)g C.(a -3.2)g D.无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为:8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是______________→______________(填化学式)。
②该反应的氧化产物是____________(填化学式);求所得混合气体的平均相对分子质量。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO![]() 、MnO
、MnO![]() 、IO
、IO![]() 。
。
①有关反应的离子方程式为__________________。
②在锰离子转化为高锰酸根离子的反应中,如果把反应后的溶液稀释到1 L,测得溶液的pH=2,求在反应中转移电子的物质的量 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将1 mol Cl2通入到含1 mol FeI2溶液中: 2Fe2++2I-+2Cl2==2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入到NaClO溶液中: SO2+H2O+ClO-==HClO+HSO | 正确;说明酸性: H2SO3强于HClO |
D | 1 mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积互相均匀混合:2AlO | 正确;AlO |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.6molL﹣1Fe2(SO4)3和1.2molL﹣1 CuSO4的混合溶液200mL,加入一定量铁粉充分反应后,测得溶液中Fe2+与Cu2+物质的量之比为2:1,则加入铁粉的物质的量为
A. 0.16mol B. 0.22mol C. 0.30mol D. 0.48mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
移取10.00 mL密度为ρg/mL的过氧化氢原溶液稀释成250mL。量取稀过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(1)用高锰酸钾法(一种氧化还原滴定法)可测定待测液中的H2O2的含量。
若需配制浓度为0.10mol·L-1的KMnO4标准溶液500 mL,应准确称取 g KMnO4(已知M(KMnO4)=158.0 g·mol-1)。
a.配制该标准溶液时,下列仪器中不必要用到的有 。(用编号表示)。
①托盘天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
b.定容时仰视读数,导致最终结果____________;(填“偏大”“偏小”或“不变”)
(2)完成并配平离子方程式:
![]() MnO4―+
MnO4―+![]() H2O2+
H2O2+![]() =
=![]() Mn2++
Mn2++![]() O2↑+
O2↑+![]()
(3)滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是___________________。
(4)重复滴定三次,平均耗用 KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的质量分数为___________。
(5)若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果____ _(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com