
 CO2��g��+H2��g������H���õ������������ݣ��ݴ˻ش��������⣺
CO2��g��+H2��g������H���õ������������ݣ��ݴ˻ش��������⣺| ʵ���� | �¶� | ��ʼ�� | ƽ���� | �ﵽƽ������ʱ�� | ||
| H2O | CO | H2 | CO2 | |||
| 1 | 650�� | 1mol | 2mol | 0.8mol | 0.8mol | 5min |
| 2 | 900�� | 0.5mol | 1mol | 0.2mol | 0.2mol | 3min |
| 3 | 900�� | a mol | b mol | c mol | d mol | t |
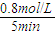 =0.16mol/��L?min�����ʴ�Ϊ��0.16��
=0.16mol/��L?min�����ʴ�Ϊ��0.16��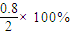 =40%��ʵ��2��CO��ת����Ϊ
=40%��ʵ��2��CO��ת����Ϊ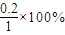 =20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����÷�Ӧ���ȣ��ʴ�Ϊ����������
=20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ����÷�Ӧ���ȣ��ʴ�Ϊ���������� CO2��g��+H2��g��
CO2��g��+H2��g��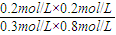 =0.167
=0.167 

 �Ͻ�ƽСѧ��������ϵ�д�
�Ͻ�ƽСѧ��������ϵ�д� �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����

| ʵ���� | T���棩 | n��CO��/n��H2�� | P��MPa�� | ||||
| i | 150 |
|
0.1 | ||||
| ii | 150 150 |
|
5 | ||||
| iii | 350 |
|
5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ͨ�� |
| ���� |
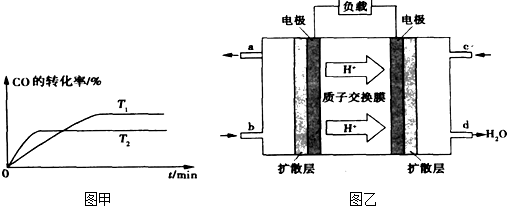
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
 �״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ����Ʊ��״���
�״�����Ϊ21���͵�����ȼ�ϣ���ҵ����CH4��H2OΪԭ��ͨ�����з�Ӧ�ٺ͢ڣ����Ʊ��״���
��CH4(g)+H2O(g)![]() CO(g)+3H2(g) DH1
CO(g)+3H2(g) DH1
��CO(g)+2H2(g)![]() CH3OH(g) DH2
CH3OH(g) DH2
��0.20 mol CH4��0.30 mol H2O(g)ͨ���ݻ�Ϊ10 L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
���¶Ȳ��䣬��С������ٵ��淴Ӧ���� (���������С�����䡱)��
�Ʒ�Ӧ�ٵ�DH1 0(�������=������)100��Cʱ��ƽ�ⳣ��ֵK= ��
����ѹǿΪ0.1Mpa�����£���amolCO��3amolH2�Ļ�������ڴ��������½��з�Ӧ�������ɼ״���Ϊ�˷�Ѱ�Һϳɼ״������˵��¶Ⱥ�ѹǿ��ijͬѧ����˶���ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С����ڿո�������ʣ���ʵ���������ݡ�
| ʵ���� | T(��C) | n(CO)/n(H2) | p(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
300��Cʱ�������������䣬���������ݻ�ѹ����ԭ����1/2����ƽ����ϵ������Ӱ����(����ĸ)�� ��
A��c(H2)���� B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��CH3OH�����ʵ������� D������ƽ��ʱc(H2)/c(CH2OH)��С
����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)=2CO2(g)��4H2O(g)DH=-1275.6 kJ��mol��1
��2CO(g)��O2(g)=2CO2(g) DH=-556.0 kJ��mol��1
 ��H2O(g)=H2O(l)DH=-44.0 kJ��mol��1
��H2O(g)=H2O(l)DH=-44.0 kJ��mol��1
д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ ��
��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�����������ͼ��ʾ�ĵ��װ�á�
�ٸõ�������ĵ缫��ӦΪ ��
�ڹ���һ��ʱ������Һ��pH��С���õ���ܷ�Ӧ�Ļ�ѧ����ʽΪ
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��14�֣��״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺ͢ڣ���CH4��H2OΪԭ�����Ʊ��״�����CH4��g����H2O ��g�� CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
��1���¶Ȳ��䣬��С���������ѹǿ���ٵķ�Ӧ���� �����������С���������䡱����ƽ���� �����ƶ���
��2����Ӧ�ٵġ�H1 0���������������������������ƽ�ⳣ������ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��
��3����ѹǿΪ0��1Mpa�����£���a mol CO��3a molH2�Ļ�������ڴ��������½��з�Ӧ�ڡ�Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С������¿ո�������ʣ���ʵ���������ݡ�
| ʵ���� | T�� | n��CO��/n��H2�� | p ��Mpa�� |
| I | 150 | 1/3 | 0��1 |
| �� |
|
| 5 |
| �� | 350 |
| 5 |
��4�������꿪���ļ״�ȼ�ϵ���Dz��ò��缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ��ʾ��ͼ���£�
��ش�
��Pt��a���缫�ĵ缫��ӦʽΪ
������õ�ع���ʱ��·��ͨ��2mol���������ĵ�CH3OH�� mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ��ɽ��ʡ������һ��ģ������������ۻ�ѧ�Ծ� ���ͣ������
��14�֣��״�����Ϊ21���͵�����ȼ�ϣ���ҵ��ͨ�����з�Ӧ�ٺ͢ڣ���CH4��H2OΪԭ�����Ʊ��״�����CH4��g����H2O ��g��  CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
CO��g����3H2��g�� ��H1 ��CO��g����2H2��g��
 CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
CH3OH��g�� ��H2 ��0��2mol CH4��0��3mol H2O��g��ͨ���ݻ�Ϊ10L���ܱ������У���һ�������·�����Ӧ�٣��ﵽƽ��ʱ��CH4��ת�������¶ȣ�ѹǿ�Ĺ�ϵ��ͼ��ʾ��
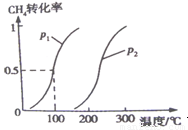
��1���¶Ȳ��䣬��С���������ѹǿ���ٵķ�Ӧ���� �����������С���������䡱����ƽ���� �����ƶ���
��2����Ӧ�ٵġ�H1 0���������������������������ƽ�ⳣ������ʽΪK= ��100�棬ѹǿΪp1ʱƽ�ⳣ����ֵ�� ��
��3����ѹǿΪ0��1Mpa�����£���a mol CO��3a molH2�Ļ�������ڴ��������½��з�Ӧ�ڡ�Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ������������ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��С������¿ո�������ʣ���ʵ���������ݡ�
|
ʵ���� |
T�� |
n��CO��/n��H2�� |
p ��Mpa�� |
|
I |
150 |
1/3 |
0��1 |
|
�� |
|
|
5 |
|
�� |
350 |
|
5 |
��4�������꿪���ļ״�ȼ�ϵ���Dz��ò��缫������е����ӽ���Ĥֻ�������Ӻ�ˮ����ͨ�����乤��ԭ��ʾ��ͼ���£�
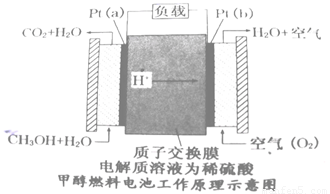
��ش�
��Pt��a���缫�ĵ缫��ӦʽΪ
������õ�ع���ʱ��·��ͨ��2mol���������ĵ�CH3OH�� mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com