
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义.
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)2NH3(g)+CO2(g)△H=+133.6kJ/mol.该反应的化学平衡常数的表达式K= . 关于该反应的下列说法正确的是(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气.
已知: 
结合①中信息,尿素还原NO(g)的热化学方程式是 .
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)═CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图2所示
则a点的正反应速率v正(CO2)b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 .
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2 . 已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)> .
【答案】
(1)c2(NH3)?c(CO2),a,2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=﹣1804.7KJ/mol,>,0.75
(2)2NO2+CO32﹣=NO3﹣+NO2﹣+CO2,c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+)
【解析】解:(1)①化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出,CO(NH2)2 (s)+H2O(l)2NH3(g)+CO2(g)平衡常数K=c2(NH3)c(CO2);
a.混合气体中只有氨气、二氧化碳,二者物质的量之比为定值2:1,平均相对分子质量不变,故a正确;
b.平衡常数只受温度影响,温度不变,平衡常数不变,增加水的用量不影响平衡常数,故b错误;
c.正反应为吸热反应,降低温度平衡逆向移动,尿素的转化率减小,故c错误,
所以答案是:c2(NH3)c(CO2);a;
②尿素在一定条件下可将氮的氧化物还原为氮气,反应方程式为:2 CO(NH2)2(s)+6 NO(g)=5 N2(g)+2CO2(g)+4 H2O(l),
已知:①CO(NH2)2 (s)+H2O(l)2NH3(g)+CO2(g)△H=+133.6kJ/mol,
由图可得热化学方程式:②4NH3(g)+6 NO(g)=5 N2(g)+6H2O(l)△H=﹣2071.9 kJ/mol,
根据盖斯定律,①×2+②可得:2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=﹣1804.7KJ/mol,
所以答案是:2CO(NH2)2(s)+6NO(g)=5N2(g)+2CO2(g)+4H2O(l)△H=﹣1804.7KJ/mol;
③氨气的体积分数从50%变化为20%后体积分数保持不变,说明b点反应达到平衡状态,a点氨气体积百分含量大于b的氨气体积百分含量,说明反应正向进行达到平衡状态,a点的正反应速率大于b点的正反应速率,故v正(CO2)>v逆(CO2);
设NH3和CO2的起始物质的量为1mol,平衡时氨气转化率为x,则:
CO2(g)+ | 2NH3(g)CO (NH2)2 (s)+ | H2O(g) | |
起始(mol) | 1 | 1 | 0 |
转化(mol) | 0.5x | x | 0.5x |
平衡(mol) | 1﹣0.5x | 1﹣x | 0.5x |
氨气的体积分数= ![]() =20%,解得x=75%,
=20%,解得x=75%,
所以答案是:>;75%;(2)9.2gNO2的物质的量= ![]() =0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2﹣水解溶液呈碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+),
=0.2mol,Na2CO3溶液完全反应生成CO2时转移电子0.1mol,反应中只有N元素化合价变化,则N的化合价分别由+4价变化为+5价和+3价,反应的离子方程式为:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2,在碱性溶液中应生成NaNO3和NaNO2,二者浓度相等,NO2﹣水解溶液呈碱性,所得溶液中的离子浓度大小关系为c(Na+)>c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+),
所以答案是:2NO2+CO32﹣=NO3﹣+NO2﹣+CO2;c(NO3﹣)>c(NO2﹣)>c(OH﹣)>c(H+).
【考点精析】根据题目的已知条件,利用化学平衡的计算的相关知识可以得到问题的答案,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验现象的记录不正确的是
A.纯净的氢气在氯气中安静的燃烧,发出苍白色火焰
B.红热的铜丝在氯气中燃烧,产生绿色的烟
C.红热的铁丝在氯气中燃烧,产生棕褐色的烟
D.将氯气通入硝酸银溶液中,生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在l~100nm 之间 B.能透过半透膜
C.加入浓氢氧化钠溶液都产生红褐色沉淀 D.颜色都呈红褐色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌、铜和稀硫酸组成的原电池,下列有关说法正确的是( ) ①锌极有气泡产生 ②电子由Zn经外电路流向Cu
③负极:Zn+2e﹣=Zn2+④Cu2+在溶液中由Cu棒向Zn棒迁移.
A.①②④
B.①②③
C.②
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 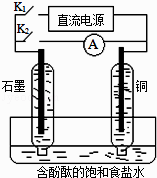
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
选项 | A | B | C | D |
a | Na | Al | Fe | Cu |
b | NaOH | Al2O3 | FeCl3 | CuSO4 |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“吃尽百味还点盐,穿尽绫罗不如棉”。食盐不仅是调味品,更在医药、化工等领域有广泛应用。下列有关叙述中正确的是
A. 食盐熔化时因离子键遭破坏故属化学变化 B. 电解饱和食盐水可制备金属钠
C. 生理盐水的浓度越接近饱和药效越好 D. 加碘食盐中的碘以 IO3- 形成存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含钴废催化剂(主要成分为Co、Fe、SiO2)为原料,制取氧化钴的流程如图1: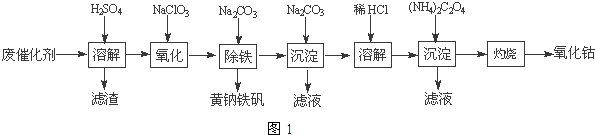
(1)溶解:溶解后过滤,将滤渣洗涤2~3次,洗液与滤液合并,其目的是;所得滤渣的主要成分是(写化学式).
(2)氧化:加热搅拌条件下加入NaClO3 , 将Fe2+氧化成Fe3+ , 其离子方程式;
已知:铁氰化钾化学式为K3[Fe(CN)6];亚铁氰化钾化学式为K4[Fe(CN)6]3H2O.
3Fe2++2[Fe(CN)6]3﹣═Fe3[Fe(CN)6]2↓(蓝色沉淀)
4Fe3++3[Fe(CN)6]4﹣═Fe4[Fe(CN)6]3↓(蓝色沉淀)
确定Fe2+是否氧化完全的方法是 . (可供选择的试剂:铁氰化钾溶液、亚铁氰化钾溶液、铁粉、KSCN溶液)
(3)除铁:加入适量的Na2CO3调节酸度,生成黄钠铁矾[Na2Fe6(SO4)4(OH)12]沉淀,写出该反应的化学方程式 .
(4)沉淀:生成沉淀碱式碳酸钴[(CoCO3)23Co(OH)2],沉淀需洗涤,洗涤的操作是 .
(5)溶解:CoCl2的溶解度曲线如图2所示.向碱式碳酸钴中加入足量稀盐酸,边加热边搅拌至完全溶解后,需趁热过滤,其原因是 . 
(6)灼烧:准确称取所得CoC2O4 1.470g,在空气中充分灼烧得0.830g氧化钴,写出氧化钴的化学式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com