
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
【答案】 根据气泡速度控制分液漏斗的活塞,使浓盐酸缓慢流下 除去氯气中的氯化氢 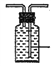 将盛NaOH溶液的洗气瓶浸在冰水中 bd 向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化
将盛NaOH溶液的洗气瓶浸在冰水中 bd 向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化
【解析】考查实验方案设计与评价,(1)保证氯气的充分利用,需要根据气泡的速度控制分液漏斗的活塞,使浓盐酸缓慢流下;(2)制备出的氯气中混有HCl,HCl与NaOH反应生成NaCl,使漂白液的纯度降低,必须除去HCl,即饱和食盐水的目的是除去氯气中的HCl;(3)装置II是收集多余氯气,应用排饱和食盐水的方法收集氯气,短进长出,装置图为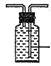 ;(4)根据信息,反应②在较高的温度下才能进行,常温下反应速率较慢,因此将盛NaOH溶液的洗气瓶浸在冰水中;(5)a、加入过量的盐酸,无现象,故a错误;b、加入过量的盐酸,再加入BaCl2溶液,出现白色沉淀,此沉淀为BaSO4,说明Na2SO3被NaClO氧化,故b正确;c、加入过量硝酸,硝酸具有强氧化性,能把Na2SO3氧化成Na2SO4,加入硝酸银产生Ag2SO4沉淀,对Cl-的检验产生干扰,故c错误;d、向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,加入盐酸,沉淀不溶,说明NaClO把Na2SO3氧化成Na2SO4,故d正确;(6)向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化。
;(4)根据信息,反应②在较高的温度下才能进行,常温下反应速率较慢,因此将盛NaOH溶液的洗气瓶浸在冰水中;(5)a、加入过量的盐酸,无现象,故a错误;b、加入过量的盐酸,再加入BaCl2溶液,出现白色沉淀,此沉淀为BaSO4,说明Na2SO3被NaClO氧化,故b正确;c、加入过量硝酸,硝酸具有强氧化性,能把Na2SO3氧化成Na2SO4,加入硝酸银产生Ag2SO4沉淀,对Cl-的检验产生干扰,故c错误;d、向混合后的溶液中加入氢氧化钡溶液,生成白色沉淀,加入盐酸,沉淀不溶,说明NaClO把Na2SO3氧化成Na2SO4,故d正确;(6)向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化。


科目:高中化学 来源: 题型:
【题目】如图为元素周期表中短周期的一部分,下列说法正确的是( ) 
A.非金属性:Y>Z>M
B.离子半径:M﹣>Z2﹣>Y﹣
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.三种元素中,Y的最高价氧化物对应的水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) 
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一密闭的体积可变的容器中加入1molN2和3molH2 , 使之在一定条件下合成氨气.反应达到平衡后,测得平衡混合气体中氨气的浓度为m molL﹣1 . 若温度不变,只改变起始加入量,使之反应重新达到平衡,此时平衡气体中氨气的浓度仍为m molL﹣1 , 加入N2、H2、NH3的物质的量分别用Xmol、Ymol、Zmol表示,应满足:
(1)体积恒定时:若X=0,Y=0,则Z压强恒定时:若X=0,Y=0,则Z
(2)体积恒定时:若X=0.65,Y , Z压强恒定时:若X=0.65,Y , Z
(3)压强恒定时,X、Y、Z应满足的关系式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
请填写下列空白:
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到,量筒内形成一段水柱,认为有氯化氢生成。
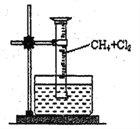
(1)该反应的反应类型为_____________________。
(2)该反应的化学方程式为(只写第一步)______________。
(3)水槽中盛放的液体应为_______。(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
(4)该实验的实验现象为:____________、_____________、试管壁上出现油状液滴
(5)该油状液滴中含有的有机产物共有_______种。
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉锭生成,认为有氯化氢生成。
(6)你认为该实验设计得出的结论是否正确的______,若不正确,理由是:_________________。
[实验三]步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同),测得pH=3.26
步骤二:收集一试管甲垸和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入l0mL蒸馏水,充分振荡,测得pH=1.00。
(7)判断该反应中有氯化氢生成的依据是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】10 g 10%的氢氧化钠溶液稀释成50 mL,所得氢氧化钠溶液的物质的量浓度为
A.0.02 mol·L-1B.0.05 mol·L-1
C.0.25 mol·L-1D.0.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及硼的化合物有着广泛的用途。请回答下列问题:
(1)硼在元素周期表中的位置为_________,电子排布式是________,硼元素有两种天然同位素10B和11B,硼元素的近似相对原子质量为10.8,则两种同位素原子的原子个数之比为_______。
(2)单质硼(B)在一定条件下与NaOH溶液反应生成NaBO2和一种气体,请写出该反应的化学方程式________________。
(3)与B一个周期的元素Be和C,它们的电离能由小到达的顺序 _______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理应用和处理氮的化合物,在生产生活中有重要意义.
(1)尿素[CO(NH2)2]是一种高效化肥,也是一种化工原料.
①以尿素为原料在一定条件下发生反应:CO(NH2)2 (s)+H2O(l)2NH3(g)+CO2(g)△H=+133.6kJ/mol.该反应的化学平衡常数的表达式K= . 关于该反应的下列说法正确的是(填序号).
a.从反应开始到平衡时容器中混合气体的平均相对分子质量保持不变
b.在平衡体系中增加水的用量可使该反应的平衡常数增大
c.降低温度使尿素的转化率增大
②尿素在一定条件下可将氮的氧化物还原为氮气.
已知: 
结合①中信息,尿素还原NO(g)的热化学方程式是 .
③密闭容器中以等物质的量的NH3和CO2为原料,在120℃、催化剂作用下反应生成尿素:CO2(g)+2NH3(g)═CO (NH2)2 (s)+H2O(g),混合气体中NH3的物质的量百分含量[φ(NH3)]随时间变化关系如图2所示
则a点的正反应速率v正(CO2)b点的逆反应速率v(逆)(CO2)(填“>”、“=”或“<”);氨气的平衡转化率是 .
(2)NO2会污染环境,可用Na2CO3溶液吸收NO2并生成CO2 . 已知9.2g NO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是;恰好反应后,使溶液中的CO2完全逸出,所得溶液呈弱碱性,则溶液中存在的所有离子浓度大小关系是c(Na+)> .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com