
����Ŀ��ij�о�С��Ϊ��̽�������������Ӧ�����������˼���ʵ�顣
����д���пհף�
[ʵ��һ]����ͼ��ʾװ�ã��ռ�һ�Թܼ���������Ļ�����壬���պ�۲쵽����Ͳ���γ�һ��ˮ������Ϊ���Ȼ������ɡ�
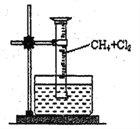
(1)�÷�Ӧ�ķ�Ӧ����Ϊ_____________________��
(2)�÷�Ӧ�Ļ�ѧ����ʽΪ(ֻд��һ��)______________��
(3)ˮ����ʢ�ŵ�Һ��ӦΪ_______��(����)
A.ˮ B.����ʯ��ˮ C.����ʳ��ˮ D.����NaHCO3��Һ
(4)��ʵ���ʵ������Ϊ��____________��_____________���Թܱ��ϳ�����״Һ��
(5)����״Һ���к��е��л����ﹲ��_______�֡�
[ʵ���]�ռ�һ�Թܼ���������Ļ�����壬���շ�Ӧ�μ�AgNO3��Һ�������а�ɫ�������ɣ���Ϊ���Ȼ������ɡ�
(6)����Ϊ��ʵ����Ƶó��Ľ����Ƿ���ȷ��______��������ȷ�������ǣ�_________________��
[ʵ����]����һ:�ռ����Թ�����������10mL����ˮ�����������DISϵͳ��pH����������Һ��pH(��ͬ)�����pH=3.26
�����:�ռ�һ�Թܼ����������Ļ������(��ռ50%)����40W���չ���¹���6min����l0mL����ˮ����������pH=1.00��
(7)�жϸ÷�Ӧ�����Ȼ������ɵ�������__________________________________��
���𰸡� ȡ����Ӧ CH4+Cl2![]() CH3Cl+HCl C ��Ͳ��Һ������ ����ɫ��ȥ 3 ����ȷ ��ˮ�м���AgNO3��ҺҲ�������ɫ���� �������õ�pHֵ�Ȳ���һ��õ�pHֵ��
CH3Cl+HCl C ��Ͳ��Һ������ ����ɫ��ȥ 3 ����ȷ ��ˮ�м���AgNO3��ҺҲ�������ɫ���� �������õ�pHֵ�Ȳ���һ��õ�pHֵ��
������������ʵ�鷽����������ۣ���1����������������ȡ����Ӧ����2���������������ȡ����Ӧ������ѧ��Ӧ����ʽΪCH4��Cl2![]() CH3Cl��HCl����3��A�������������ˮ������������������Ӧ����˲���ʢ��H2O����A����B�������뱥��ʯ��ˮ������Ӧ��ˮ���в���ʢ�ű���ʯ��ˮ����B����C������ʳ��ˮ���������ĵ��ܽ�ȣ��ұ���ʳ��ˮ���������ɵ�HCl�������Ͳ������ѹǿ��С����Ͳ�е�Һ����������C��ȷ��D������HCl����NaHCO3������Ӧ����CO2����Ͳ�е�Һ�治����������D����4������������������Ӧ������ɫ������ȥ����ΪCH2Cl2��CHCl3��CCl4ΪҺ�壬��HCl���ڱ���ʳ��ˮ�������Ͳ��ѹǿ��С������Ͳ��Һ������������ʳ��ˮ���о�����������Ͳ�ڱ�����״Һ������5������ΪCH3Cl��CH2Cl2��CHCl3��CCl4������CH3ClΪ��̬����������ΪҺ̬�������״Һ���к��е��л���CH2Cl2��CHCl3��CCl4������3�֣���6����������ˮ����Һ�д���Cl��������AgNO3��Һ��Ҳ�ܲ�����ɫ��������˸�ʵ��ó����۲���ȷ����7������ʵ�飬��������pHС�ڲ���I��ĵ�pH��˵��c(H��)����������HCl��
CH3Cl��HCl����3��A�������������ˮ������������������Ӧ����˲���ʢ��H2O����A����B�������뱥��ʯ��ˮ������Ӧ��ˮ���в���ʢ�ű���ʯ��ˮ����B����C������ʳ��ˮ���������ĵ��ܽ�ȣ��ұ���ʳ��ˮ���������ɵ�HCl�������Ͳ������ѹǿ��С����Ͳ�е�Һ����������C��ȷ��D������HCl����NaHCO3������Ӧ����CO2����Ͳ�е�Һ�治����������D����4������������������Ӧ������ɫ������ȥ����ΪCH2Cl2��CHCl3��CCl4ΪҺ�壬��HCl���ڱ���ʳ��ˮ�������Ͳ��ѹǿ��С������Ͳ��Һ������������ʳ��ˮ���о�����������Ͳ�ڱ�����״Һ������5������ΪCH3Cl��CH2Cl2��CHCl3��CCl4������CH3ClΪ��̬����������ΪҺ̬�������״Һ���к��е��л���CH2Cl2��CHCl3��CCl4������3�֣���6����������ˮ����Һ�д���Cl��������AgNO3��Һ��Ҳ�ܲ�����ɫ��������˸�ʵ��ó����۲���ȷ����7������ʵ�飬��������pHС�ڲ���I��ĵ�pH��˵��c(H��)����������HCl��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֹ�ҵ�Ʊ�SrCl6H2O������ �������£�
��֪����M��SrCl26H2O��=267g/mol��
��Ksp��SrSO4��=3.3��10��7��Ksp��BaSO4��=1.1��10��10��
�۾������ȡ����Һ�г�����Sr2+��Cl���⣬����������Ba2+���ʣ�
��1�������������±��գ���2mol SrSO4��ֻ��S����ԭ��ת����16mol���ӣ�д���÷�Ӧ�Ļ�ѧ����ʽ�� ��
��2������2������������������ ��
��3�����������Ŀ������Ϊ�����ԭ�ϵ������ʣ���Һ��Sr2+��Ũ��Ӧ������ mol/L��ע����ʱ��Һ��Ba2+Ũ��Ϊ1��10��5 mol/L����
��4����Ʒ���ȼ�⣺��ȡ1.000g��Ʒ�ܽ�������ˮ�У������м��뺬AgNO31.100��10��2 mol��AgNO3��Һ����Һ�г�Cl���⣬����������Ag+��Ӧ�����ӣ�����Cl����ȫ�������ú�Fe3+����Һ��ָʾ������0.2000mol/L��NH4SCN����Һ�ζ�ʣ���AgNO3 �� ʹʣ���Ag+ ��AgSCN��ɫ��������ʽ������
�ٵζ���Ӧ�ﵽ�յ�������� ��
�����ζ�������ȥ����Ũ�ȵ�NH4SCN��Һ20.00mL�����Ʒ��SrCl26H2O�������ٷֺ���Ϊ������4λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��N��O��Si��S��Al��Fe��Cu�dz���������Ԫ�أ�
��1��Siλ��Ԫ�����ڱ������ڵ��壮
��2��Cuԭ�ӵļ۲�����Ų�ͼΪ ��
��3����̬Feԭ������δ�ɶԵ��ӣ�Fe3+�ĵ����Ų�ʽΪ �� �������軯�ؼ���Fe3+ �� �γɵ���������ɫΪ ��
��4���á�����������գ�
���Ӱ뾶 | �縺�� | �۵� | ���� |
O2�� Na+ | FO | ���ʯ ����� | H2SO4HClO4 |
��5����Ԫ�غ�������Ԫ���γɵĶ�Ԫ���ۻ������У����ӳ������Σ��÷��ӵ�����ԭ�ӵ��ӻ���ʽΪ�������мȺ��м��Թ��ۼ����ֺ��зǼ��Թ��ۼ��Ļ����������ѧʽ����дһ�֣���
��6��O��Cu�γɵ�һ�����ӻ�����ľ���ṹ��ͼ����ͭ���ӵĵ��Ϊ �� 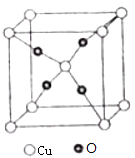
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.д�����з�Ӧ�Ļ�ѧ����ʽ���ꡰ*������д�����ӷ�Ӧ����ʽ
(1)*�����ǻ�����������Һ��ͨ������Ķ�����̼����_________��
(2)*���Ȼ�����Һ�м��������ˮ_________��
(3)ʵ��������Ũ��ˮ������ȡ����_________��
(4)*ʵ�������ö������̹�����ȡ����_________��
(5)*����84����Һ���͡�����顱(��Ҫ�ɷ�ΪŨ����)��ϲ����ж�����_________��
II.д���������ʵĵ���ʽ
(6)����(C2H6) _________��
(7)��������_________��
III.д��һ�ȱ���(C3H7Cl)�Ľṹ��ʽ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ȤС������ͼIװ����ȡƯ��Һ(�������Ѽ��飬�Լ�������)�����о���������ʡ�

(1)Ϊ��֤�����ij�����ã�Ӧ��ȡ�IJ�����__________________________��
(2)����ʳ��ˮ��������__________________________________________��
(3)����ͼIIװ���ռ�������������������߿��ڻ�����װ�ü�ͼ��(�뻭�ڴ����) _____��
(4)��С��ͬѧ������װ���Ƶõ�Ư��Һ��NaClO��Ũ��ƫ�͡��������Ϸ��֣�����Һ�з�����Ӧ:
��Cl2+2NaOH=NaCl+NaClO+H2O ��3NaC1O=2NaCl+NaClO3
��֪��Ӧ�٢ھ�Ϊ���ȷ�Ӧ���ҷ�Ӧ�ٵķ�Ӧ���ʺܿ죬����Ӧ����Ҫ�ڽϸߵ��¶��½��У��������·�Ӧ���ʽ������������ϣ����ͼIװ������Ľ�����:______________________��
(5)�ķ�����С��ͬѧ�Ƶ��˽ϸ�Ũ�ȵ�NaClO��Һ�����ǰ�Ư��Һ�͵��з�̪�ĺ�ɫNa2SO3��Һ��Ϻõ���ɫ��Һ��
�������:
i. NaClO��Na2SO3������
ii. NaClO�ѷ�̪������
iii. NaClO��Na2SO3�ͷ�̪��������
������ʵ�鷽���п���֤��NaClO������Na2SO3����________
a.���Ϻ����Һ�м����������
b.���Ϻ����Һ�м���������ᣬ�ټ����Ȼ�����Һ
c.���Ϻ����Һ�м���������ᣬ�ټ�����������Һ
d.���Ϻ����Һ�м������Ȼ�����Һ���ټ����������
��Ϊ֤��NaClO�����˷�̪���ɽ��е�ʵ����____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. 0.1 mol ��![]() ������0.6NA������
������0.6NA������
B. 7.1g Cl2ͨ��������NaOH��Һ�У���Ӧת�Ƶ��ӵ���ĿΪ0.3NA
C. ��״���£�1.12L ��SO2������ԭ����ĿΪ0.2NA
D. ��������MnO2�뺬HCl 4 mol��Ũ�����Ϻ��ּ��ȣ����ɵ����������ĿΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ɶ����ڳ���Ԫ���γɵĴ�����A��B��C��Dת����ϵ��ͼ1���£�����A������B֮��ķ�Ӧ������Һ�н��У� 
��1����AΪ�������ʣ�C�ǵ���ɫ���壬D��һԪǿ� ������B�����ѧʽ����
�ڻ�����C�ĵ���ʽΪ��������D��������ѧ���������� ��
���ڳ����£���pH=a�Ĵ�����Һ�м�������pH=b��D��Һ����a+b=14�����ַ�Ӧ��������Һ�и������ӵ�Ũ���ɴ�С��˳���ǣ� ��
��2����AΪ�ǽ������ʣ�C����ɫ���壬D��һԪǿ�ᣮ ��BΪ���ѧʽ����
�ڻ�����C��H2O��Ӧ��ѧ����ʽ �� �������뻹ԭ����������Ϊ ��
��3��ijͬѧ��ͼ2װ������й�̽��ʵ�飮 ���Թ��з�����Ӧ�����ӷ���ʽΪ ��
���Թ��й۲쵽��ʵ������ʱ��˵��NO2������Ũ�����У�Ũ����ܸ���NO2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ˮ����Խ��Խ�����������ӣ�����ͨ�� ![]() Ĥ��س�ȥ��ˮ�е������ƺͶ��ȱ��ӣ�����������ԭ����ͼ��ʾ������˵����ȷ���ǣ�
Ĥ��س�ȥ��ˮ�е������ƺͶ��ȱ��ӣ�����������ԭ����ͼ��ʾ������˵����ȷ���ǣ� 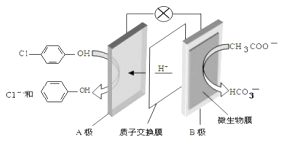
A.���������B���ص��߾�С��������A��
B.A���ĵ缫��ӦʽΪ ![]() +e���TCl��+
+e���TCl��+ ![]()
C.�����·����0.2mole��ת��ʱ��ͨ�����ӽ���Ĥ��H+�ĸ���Ϊ0.1NA
D.B��Ϊ��ص�������������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС�����������ʵ��װ�ã�ʵ��ʱ���ȶϿ�K2 �� �պ�K1 �� �����������ݲ�����һ��ʱ��Ͽ�K1 �� �պ�K2 �� ���ֵ�����ָ��ƫת�������й�������ȷ���ǣ� �� 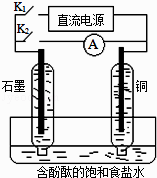
A.�Ͽ�K2 �� �պ�K1ʱ���ܷ�Ӧ�����ӷ���ʽΪ��2H++2Cl�� ![]() Cl2��+H2��
Cl2��+H2��
B.�Ͽ�K2 �� �պ�K1ʱ��ʯī�缫������Һ���
C.�Ͽ�K1 �� �պ�K2ʱ��ͭ�缫�ϵĵ缫��ӦΪ��Cl2+2e��=2Cl��
D.�Ͽ�K1 �� �պ�K2ʱ��ʯī�缫������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com