
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 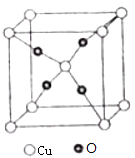
【答案】
(1)三,IVA
(2)![]()
(3)4,1s22s22p63s23p63d5,血红色
(4)>,>,>,<
(5)sp3,H2O2 或N2H4
(6)+1
【解析】解:(1)Si元素原子核外有3个电子层,最外层电子数为4,处于周期表中第三周期IVA族,
所以答案是:三、IVA;
(2)Cu原子价层电子排布式为3d104s1,价层电子排布图为: ![]() ,
,
所以答案是: ![]() ;
;
(3)Fe原子核外电子排布式为1s22s22p63s23p63d64s2,基态Fe原子3d轨道有4个未成对电子,失去4s能级2个电子及3d能级1个电子形成Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5,可用硫氰化钾检验Fe3+,形成的配合物的颜色为血红色,
所以答案是:4;1s22s22p63s23p63d5;血红色;
(4)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2﹣>Na+;
同周期自左而右,元素电负性增大,故电负性F>O;
金刚石与晶体硅均属于原子晶体,C原子半径较小,键长更短,故C﹣C键更稳定,熔沸点金刚石>晶体硅;
非金属性S<Cl,非金属性越强,最高价含氧酸的酸性越强,故酸性:H2SO4<HClO4,
所以答案是:>;>;>;<;
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形为NH3,分子中N原子形成3个N﹣H键,含有1对孤电子对,故N原子采取sp3杂化,分子中既含有极性共价键、又含有非极性共价键的化合物是H2O2 或N2H4,
所以答案是:sp3; H2O2 或N2H4;
(6)铜离子个数=1+8× ![]() =2,氧离子个数=4,所以该化合物为Cu2O,则铜离子的电荷为+1,
=2,氧离子个数=4,所以该化合物为Cu2O,则铜离子的电荷为+1,
所以答案是:+1.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】关于化学键的叙述中,正确的是
A. HCl电离产生H+和Cl-,可判断HCl分子中存在离子键
B. 不同元素组成的多原子分子中的化学键一定全是极性键
C. 化学键是指使原子或离子相互结合的静电吸引作用力
D. NaHSO4固体中含有的阴离子与阳离子的个数比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果。下列关于KNO3的古代文献,对其说明不合理的是
目的 | 古代文献 | 说明 | |
A | 性质 | “…凡研消(KNO3)不以铁碾入石臼,相激火生,祸不可测”一《天工开物》 | KNO3能自燃 |
B | 鉴别 | 区分硝石(KNO3)和朴消(Na2SO4):“以火烧之,紫青烟起,乃真硝石也” ——《本草经集注》 | 利用焰色反应 |
C | 提纯 | “…(KNO3)所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”——《开宝本草》 | 溶解、蒸发、结晶 |
D | 使用 | “(火药)乃焰消(KNO3)、硫磺、山木炭所合,以为烽燧铜诸药者"——《本草纲目》 | 利用KNO3的氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述:①我国科学家在世界上第一次人工合成结晶牛胰岛素;②最早发现电子的是英国科学家道尔顿;③创造联合制碱法的是我国著名科学家侯德榜;④首先制得氧气的是法国科学家拉瓦锡;⑤有机物的元素定量分析最早是由牛顿提出的,其中正确的是( )
A.只有①
B.①和③
C.①②③
D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)容量瓶不能用于(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1mol/L.
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 . 在配制过程中,下列操作中,能引起误差偏高的有(填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) 
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究甲烷和氯气反应的情况,设计了几个实验。
请填写下列空白:
[实验一]用如图所示装置,收集一试管甲烷和氯气的混合气体,光照后观察到,量筒内形成一段水柱,认为有氯化氢生成。
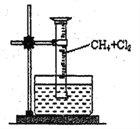
(1)该反应的反应类型为_____________________。
(2)该反应的化学方程式为(只写第一步)______________。
(3)水槽中盛放的液体应为_______。(填标号)
A.水 B.饱和石灰水 C.饱和食盐水 D.饱和NaHCO3溶液
(4)该实验的实验现象为:____________、_____________、试管壁上出现油状液滴
(5)该油状液滴中含有的有机产物共有_______种。
[实验二]收集一试管甲烷和氯气的混合气体,光照反应后,滴加AgNO3溶液,看到有白色沉锭生成,认为有氯化氢生成。
(6)你认为该实验设计得出的结论是否正确的______,若不正确,理由是:_________________。
[实验三]步骤一:收集半试管氯气,加入10mL蒸馏水,充分振荡,采用DIS系统的pH传感器测溶液的pH(下同),测得pH=3.26
步骤二:收集一试管甲垸和氯气的混合气体(各占50%),在40W的日光灯下光照6min后,加入l0mL蒸馏水,充分振荡,测得pH=1.00。
(7)判断该反应中有氯化氢生成的依据是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应时,既要考虑物质变化与能量变化,也要关注反应的快慢与限度。回答下列问题:
I.现有反应:①CaCO3=CaO+CO2↑,②Fe +H2SO4=FeSO4+ H2↑。
(1)两反应中属于吸热反应的是____(填序号)。
(2)Fe-Cu 原电池的装置如图所示。
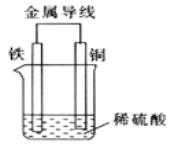
①溶液中H+向______(填“铁”或“铜” )电极方向移动。
②正极的现象是_______,负极的电极反应式为_________。
II.某可逆反应:2A(g)![]() B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3 种不同条件下进行,B和D的起始浓度均为0,反应物A 的浓度随反应时间的变化情况如下表:
 (3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(3)实验1中,在10~20 min内,以物质A表示的平均反应速率为_______mol/(L·min) ,50min时,v(正)______(填“<”“>”或“=”)v(逆)。
(4)0~20min内,实验2 比实验1的反应速率______ (填“快”或“慢”),其原因可能是_______。
(5)实验3 比实验1的反应速率快,其原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com