
【题目】实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
(1)容量瓶不能用于(填序号).
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(2)根据计算用托盘天平称取NaOH的质量为g.在实验中其他操作均正确,若定容时仰视刻度线,则所得溶液浓度0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度0.1mol/L.
(3)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL(计算结果保留一位小数)配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 . 在配制过程中,下列操作中,能引起误差偏高的有(填代号).
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
④定容时,俯视刻度线.
【答案】
(1)B,C,D
(2)2.0,小于,小于
(3)13.6,将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌,①④
【解析】解:(1)容量瓶瓶为配制特定体积的一定物质的量浓度溶液的专用仪器,只有刻度线,没有刻度,所以不能用来量取容量瓶规格以下的任意体积的液体,容量瓶为精密仪器,不能用来溶解固体,不能长时间储存溶液,
故选:BCD;
(2)需要0.1mol/LNaOH溶液450mL,应选择500mL容量瓶,实际配制500mL溶液,需要溶质氢氧化钠的质量m=0.1mol/L×0.5L×40g/mol=2.0g;
定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏小;若NaOH溶液在转移至容量瓶时,洒落了少许,导致溶质的物质的量偏小,溶液浓度偏小;
所以答案是:2.0; 小于;小于;
(3)质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度C= ![]() =18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释规则:V×18.4mol/L=0.5mol/L×0.5L,解得V=13.6mL;
=18.4mol/L,设需要浓硫酸体积为V,则依据溶液稀释规则:V×18.4mol/L=0.5mol/L×0.5L,解得V=13.6mL;
浓硫酸稀释的正确操作方法:将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌;
①未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中,冷却后,溶液体积偏小,溶液浓度偏高,故选;
②定容时,加蒸馏水超过刻度线,又用胶头滴管吸出,导致溶质的物质的量偏小,溶液浓度偏小,故不选;
③定容摇匀后,发现液面低于刻度线,又用胶头滴管加蒸馏水至刻度线,导致溶液体积偏大,溶液浓度偏小,故不选;
④定容时,俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故选;
所以答案是:13.6mL;将浓硫酸沿器壁缓缓倒入水中,并用玻璃棒不断搅拌; ①④.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】请完成下面两个小题:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库.
(1)3He是高效核能原料,其原子核内中子数为
(2)Na的原子结构示意图为 ,Na在氧气中完全燃烧所得产物的电子式为 .
(3)MgCl2在工业上应用广泛,可由MgO制备.
①MgO的熔点比BaO的熔点 (填“高”或”低”).
②月球上某矿石经处理得到的MgO中含有少量SiO2 , SiO2的晶体类型为 ;所含化学键类型为 .
③MgO与碳粉和足量氯气在一定条件下反应可制备MgCl2 . 若尾气可用足量NaOH溶液完全吸收,则生成的盐有 (写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.烧碱、小苏打、醋酸、次氯酸均为电解质
B.碘酒、牛奶、豆浆、蔗糖水均为胶体
C.是否具有丁达尔效应是区分溶液、胶体和浊液的本质原因
D.物质可根据在水中或熔化状态下的导电性分为电解质与非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于纯净物、混合物、电解质、非电解质的正确组合是( )
纯净物 | 混合物 | 电解质 | 非电解质 | |
A | 盐酸 | 冰水混合物 | 硫酸 | 干冰 |
B | 蒸馏水 | 蔗糖溶液 | 氧化铝 | 二氧化硫 |
C | 明矾 | 盐酸 | 铁 | 碳酸钙 |
D | 胆矾 | 食盐水 | 氯化铜 | 碳酸钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 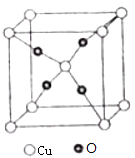
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迄今为止合成的最重的元素是112号元素,它是用 ![]() Zn高能原子轰击
Zn高能原子轰击 ![]() Pb的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子(
Pb的靶子,使锌核与铅核熔合而得,每生成一个112号元素的原子( ![]() R)的同时向外释放出一个中子.下列说法错误的是( )
R)的同时向外释放出一个中子.下列说法错误的是( )
A.112号元素是金属元素
B.112号元素位于第七周期,是主族元素
C.![]() R原子中子数为165
R原子中子数为165
D.112号元素为放射性元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列反应的化学方程式,标“*”的请写出离子反应方程式
(1)*向四羟基合铝酸纳溶液中通入过量的二氧化碳气体_________。
(2)*向氯化铝溶液中加入过量氨水_________。
(3)实验室利用浓氨水快速制取氨气_________。
(4)*实验室利用二氧化锰固体制取氯气_________。
(5)*将“84消毒液”和“洁厕灵”(主要成分为浓盐酸)混合产生有毒气体_________。
II.写出下列物质的电子式
(6)乙烷(C2H6) _________。
(7)氢氧化钠_________。
III.写出一氯丙烷(C3H7Cl)的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 0.1 mol 的![]() 中,含有0.6NA个中子
中,含有0.6NA个中子
B. 7.1g Cl2通入足量的NaOH溶液中,反应转移电子的数目为0.3NA
C. 标准状况下,1.12L 的SO2所含的原子数目为0.2NA
D. 将足量的MnO2与含HCl 4 mol的浓盐酸混合后充分加热,生成的气体分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是
A.自然界中的硫都是以化合态存在的
B.硫既具有氧化性,又具有还原性
C.硫化氢气体具有可燃性
D.附着在试管内壁的硫,可以用CS2洗涤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com