
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素.下列说法不正确的是( ) 
A.原子半径Z<M
B.Y的最高价氧化物对应水化物的酸性比X的弱
C.X的最简单气态氢化物的热稳定性比Z的小
D.Z位于元素周期表中第2周期第ⅥA族
【答案】B
【解析】解:根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O. A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大,因此原子半径Al>S>O,故A正确;
B、由于非金属性:N>Si,所以最高价氧化物对应水化物的酸性:HNO3>H2SiO3 , 故B错误;
C、由于非金属性:O>Si,所以气态氢化物的稳定性:H2O>SiH4 , 故C正确;
D、O原子含有2个电子层,最外层含有6个电子,因此O位于元素周期表中第二周期、第ⅥA族,故D正确;
故选:B.
根据元素周期表中短周期部分的结构和元素位置可知:金属M为Al,X为Si,Y为N,Z为O.
A、同周期自左到右原子半径逐渐减小,同族原子半径逐渐增大;
B、根据非金属性越强,最高价氧化物对应水化物的酸性越强分析;
C、根据非金属性越强,气态氢化物的稳定性越强分析;
D、根据O原子含有2个电子层,最外层含有6个电子分析.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】乙烷可以发生如下反应:CH3﹣CH3+Br2→CH3CH2Br+HBr.这个反应在有机化学中属于( )
A.裂解反应
B.取代反应
C.分解反应
D.加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁有多种价态,将14.4 g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2 g铁的氧化物,则该铁的氧化物是( )
A. FeO B. Fe2O3
C. Fe3O4 D. FeO和Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、O、Si、S、Al、Fe、Cu是常见的七种元素.
(1)Si位于元素周期表第周期第族.
(2)Cu原子的价层电子排布图为 .
(3)基态Fe原子有个未成对电子,Fe3+的电子排布式为 . 可用硫氰化钾检验Fe3+ , 形成的配合物的颜色为 .
(4)用“>”或“<”填空:
离子半径 | 电负性 | 熔点 | 酸性 |
O2﹣ Na+ | FO | 金刚石 晶体硅 | H2SO4HClO4 |
(5)氢元素和上述非元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键、又含有非极性共价键的化合物是(填化学式,任写一种).
(6)O和Cu形成的一种离子化合物的晶体结构如图,则铜离子的电荷为 . 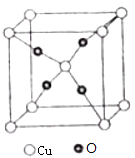
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废弃物的综合利用既有利于节约资源,又有利于保护环境,实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO,制备流程图如下:

已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH熔液生成[Zn(OH)4]2-下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol/L计算)。
Fe3+ | Fe2+ | Zn2+ | |
开始沉淀的pH | 1.1 | 5.8 | 5.9 |
沉淀完全的pH | 3.0 | 8.8 | 8.9 |
请回答下列问题:
(1)滤液A中加入H2O2反应的离子方程式为__________________________________。
(2)加入ZnO调节pH=a的目的是___________________,a的范围是______________。
(3)下列试剂可作为Y试剂的是______________。
A.ZnO B.NaOH C.Na2CO3 D.ZnSO4
(4)若在滤液C中逐滴加入盐酸直到过量,则产生的现象是____________________。
(5)由不溶物E生成溶液D的化学方程式为____________________________________。
(6)由溶液D制胆矾晶体包含的主要操作步骤是,蒸发浓缩、________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.写出下列反应的化学方程式,标“*”的请写出离子反应方程式
(1)*向四羟基合铝酸纳溶液中通入过量的二氧化碳气体_________。
(2)*向氯化铝溶液中加入过量氨水_________。
(3)实验室利用浓氨水快速制取氨气_________。
(4)*实验室利用二氧化锰固体制取氯气_________。
(5)*将“84消毒液”和“洁厕灵”(主要成分为浓盐酸)混合产生有毒气体_________。
II.写出下列物质的电子式
(6)乙烷(C2H6) _________。
(7)氢氧化钠_________。
III.写出一氯丙烷(C3H7Cl)的结构简式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校兴趣小组用如图I装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质。

(1)为保证氯气的充分利用,应采取的操作是__________________________。
(2)饱和食盐水的作用是__________________________________________。
(3)若用图II装置收集多余的氯气。请在虚线框内画出该装置简图,(请画在答题卡上) _____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低。查阅资料发现,在溶液中发生反应:
①Cl2+2NaOH=NaCl+NaClO+H2O ②3NaC1O=2NaCl+NaClO3
已知反应①②均为放热反应,且反应①的反应速率很快,而反应②需要在较高的温度下进行,在室温下反应速率较慢,根据资料,请对图I装置提出改进建议:______________________。
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液,他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液。
提出猜想:
i. NaClO把Na2SO3氧化了
ii. NaClO把酚酞氧化了
iii. NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是________
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡熔液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氯化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知由短周期常见元素形成的纯净物A、B、C、D转化关系如图1琐事,物质A与物质B之间的反应不再溶液中进行. 
(1)若A为金属单质,C是淡黄色固体,D是一元强碱. ①物质B是(填化学式).
②化合物C的电子式为;化合物D中所含化学键的类型是 .
③在常温下,向pH=a的醋酸溶液中加入等体积pH=b的D溶液,且a+b=14,则充分反应后,所得溶液中各种离子的浓度由大到小的顺序是: .
(2)若A为非金属单质,C是有色气体,D是一元强酸. ①B为(填化学式).
②化合物C与H2O反应化学方程式 , 氧化剂与还原剂的质量比为 .
(3)某同学用图2装置完成有关探究实验. Ⅰ试管中发生反应的离子方程式为 .
Ⅱ试管中观察到的实验现象时,说明NO2能溶于浓硫酸中,浓硫酸不能干燥NO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁溶液与氢氧化铁胶体具有的共同性质是
A.分散质颗粒直径都在l~100nm 之间 B.能透过半透膜
C.加入浓氢氧化钠溶液都产生红褐色沉淀 D.颜色都呈红褐色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com