
水是生命之源。饮用水消毒作为控制水质的一个重要环节,液氯消毒是最早的饮用水消毒方法。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著地杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)氯气溶于水能杀菌消毒的原因是????????????????????????????????????????? 。
(2)在ClO2的制备方法中,有下列两种制备方法:
方法一:NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:C6H12O6+24NaClO3+12H2SO4=24ClO2↑+6CO2↑+18H2O+12Na2SO4
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是??????????????????????????????????? 。
(3)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-).2001年我国卫生部规定,饮用水ClO2-的含量应不超过0.2 mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。当pH≤2.0时,ClO2-也能被I-完全还原成Cl-。反应生成的I2用标准Na2S2O3溶液滴定:2Na2S2O3+I2=Na2S4O6+2NaI

①请写出pH≤2.0时,ClO2-与I-反应的离子方程式?????????????????????????????????????????? 。
②配制Na2S2O3标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的???? (填字母代号)。
 ??????
??????  ???????
???????  ???????
???????  ??????
?????? 
a??????????? b??????????? c???????? d???????? e
③请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0
步骤3:加入足量的KI晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:调节溶液的pH≤2.0。
步骤6;再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
④滴定终点的现象是?????????????????????????????????????????????????? 。
⑤根据上述分析数据,测得该引用水样中的ClO2-的浓度为????? mg·L-1(用含字母的代数式表示)。
(4)判断下列操作对ClO2-的浓度测定结果的影响(填“偏高”、“偏低”或“无影响”)
① 若在配制标准溶液过程中,烧杯中的Na2S2O3溶液有少量溅出,使测定结果?????????????????? 。
② 若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果???????? 。
(1)生成的HClO具有强氧化性,可以杀菌(2分)
(2)方法二制备的ClO2中不含Cl2(2分)
(3)①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②a c(2分)
③(溶液由蓝色变为无色,(2分)⑤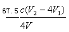 ×103(2分)
×103(2分)
(4)①偏高 (2分) ②偏低(2分)
【解析】
试题分析:(1)氯气的自来水消毒属于氢氧化性消毒,因此原理是氯气与水反应生成的HClO有强氧化性,起到杀菌消毒作用。
(2)根据题干中的介绍,氯气用于自来水消毒容易生成对人体有害的有机氯代物,所以方法二中产生的ClO2气体中不含氯气,因此制得的二氧化氯更加的安全。
(3) ①从本题题干和图像中得知,溶液pH≤2.0时,ClO2-被I- 还原为Cl- ,因此反应的离子方程式为ClO2-+4H++4I-=Cl-+2I2+2H2O,要注意酸性环境。
②一定浓度溶液的配制需要使用的仪器主要的还有容量瓶、胶头滴管,故选ac。④待滴定溶液中含有碘单质,因此与淀粉作用显蓝色,所以加入Na2S2O3 与单质碘反应,当碘反应完的时候,溶液不显蓝色,故描述时要注意规范表达。
⑤本小题计算稍微有些复杂,首先要了解整个滴定的过程:含有ClO2、ClO2- 的水,碱性下加KI溶液把ClO2 反应为ClO2- ,生成的碘单质用标准液滴定;得到的总的ClO2- 再在酸性条件下与KI反应,又生成一部分碘单质,再用标准液滴定。因此整个过程分为两个阶段。
第一步滴定(生成了一部分ClO2- ):2ClO2+2I-= 2ClO2- +? I2
2Na2S2O3? + I2?? =Na2S4O6+2NaI
cV1?????? 0.5cV1???????? cV1??? 0.5cV1
第二步滴定(反应总的ClO2- )ClO2-+ 4H++4I-=Cl-+ 2I2 +2H2O
2Na2S2O3+I2? =? Na2S4O6+2NaI
0.25cV2????????????? ??????????? 0.5cV2??????????? ?????? cV2 ?? 0.5cV2
引用水样中的ClO2-的浓度等于总的ClO2-减去第一步滴定产生的ClO2- ,因此有:
C(ClO2-)=n总(ClO2-)—n(ClO2-)/V=0.25cV2—cV1 /V,要注意化成质量浓度,所以C(ClO2-)= 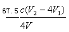 ×103 mg·L-1 。
×103 mg·L-1 。
(4)①滴定过程中若有标准液溅出损失,则从滴定管上读出的标准液体积偏高,所以计算得到的浓度结果会偏大。
②若在滴定终点读取标准液体积时,俯视读数,则读出的标准液体积会偏小,所以计算得到的浓度会偏低。
考点:本题考查的氧化还原滴定实验探究、计算、误差分析。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |

- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解


查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)水是生命之源。饮用水消毒剂作为控制水质的一个重要环节,令世人关注。
⑴液氯消毒是最早的饮用水消毒方法。氯气溶于水能杀菌消毒的原因是:
。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。
臭氧(O3)是优良的水消毒剂。但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐 (BrO- 3)。而溴酸盐 (BrO- 3)是对人体有致癌作用的化合物,我国规定饮用水中BrO- 3含量在10μg / L以下。测定BrO- 3浓度可用离子色谱法。
⑵水中的氯离子(Cl-)对BrO-3测定干扰很大,需要先除去氯离子(Cl-)。用右图的装置可除去水中的氯离子(Cl-)。
装置中Ag是 极(填电极名称),
Ag电极的电极反应式是 。
⑶ O3氧化溴离子的原理如下:
已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO- 3主要是由BrO-与O3反应生成。
对影响生成BrO- 3速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度。
假设②:
假设③:
⑷设计实验验证假设①。
验证实验操作:
a. 配制250 mL 50 mg / L KBr溶液,加入 15 mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份。
b.
实验中要测定的量是
实验结论是
查看答案和解析>>
科目:高中化学 来源:2012届安徽省黄山市高三七校联考化学试卷 题型:填空题
(15分)水是生命之源。饮用水消毒剂作为控制水质的一个重要环节,令世人关注。
⑴液氯消毒是最早的饮用水消毒方法。氯气溶于水能杀菌消毒的原因是:
。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。
臭氧(O3)是优良的水消毒剂。但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐 (BrO- 3)。而溴酸盐 (BrO- 3)是对人体有致癌作用的化合物,我国规定饮用水中BrO- 3含量在10μg / L以下。测定BrO- 3浓度可用离子色谱法。
⑵水中的氯离子(Cl-)对BrO-3测定干扰很大,需要先除去氯离子(Cl-)。用右图的装置可除去水中的氯离子(Cl-)。
装置中Ag是 极(填电极名称),
Ag电极的电极反应式是 。
⑶ O3氧化溴离子的原理如下:
已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO- 3主要是由BrO-与O3反应生成。
对影响生成BrO- 3速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度。
假设②:
假设③:
⑷设计实验验 证假设①。
证假设①。
验证实验操作:
a.配制250 mL 50 mg / L KBr溶液,加入 15 mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份。
b.
实验中要测定的量是
实验结论是 
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省黄山市高三七校联考化学试卷 题型:填空题
(15分)水是生命之源。饮用水消毒剂作为控制水质的一个重要环节,令世人关注。
⑴液氯消毒是最早的饮用水消毒方法。氯气溶于水能杀菌消毒的原因是:
。近年来科学家提出,氯气能与水中的有机物发生反应,生成的有机氯化物可能对人体有害。
臭氧(O3)是优良的水消毒剂。但当水中含溴离子(Br-)时,臭氧可氧化溴离子(Br-)为溴酸盐 (BrO- 3)。而溴酸盐 (BrO- 3)是对人体有致癌作用的化合物,我国规定饮用水中BrO- 3含量在10μg / L以下。测定BrO- 3浓度可用离子色谱法。
⑵水中的氯离子(Cl-)对BrO-3测定干扰很大,需要先除去氯离子(Cl-)。用右图的装置可除去水中的氯离子(Cl-)。
装置中Ag是 极(填电极名称),
Ag电极的电极反应式是 。

⑶ O3氧化溴离子的原理如下:

已知HBrO是一种弱酸,O3与HBrO反应很慢,BrO- 3主要是由BrO-与O3反应生成。
对影响生成BrO- 3速率的因素提出如下假设:(请你完成假设②和假设③)
假设①:反应的温度。
假设②:
假设③:
⑷设计实验验证假设①。
验证实验操作:
a. 配制250 mL 50 mg / L KBr溶液,加入 15 mL 某种pH=7的缓冲溶液(维持溶液的pH基本不变),并将溶液分为2份。
b.
实验中要测定的量是
实验结论是
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com