
【题目】W.X.Y.Z.Q五种元素的原子序数依次增大。其中X原子的价电子构型为nsnnpn,Y原子的L电子层中,有三个未成对的电子,且无空轨道;W.Z的原子序数相差18,且Z原子的第一电离能在同周期中最低,Q+中所有电子正好充满K.L.M三个电子层,请回答下列问题:
(1)写出Y3-离子的电子排布式________。
(2)Y.Z.Q电负性由小到大的顺序是________。(填元素符号)
(3)已知Y的氢化物能与Q2+形成配离子[Q(YH3)4]2+,该配离子中存在的化学键有________。(填标号)
A.氢键 B离子键 C.共价键 D.配位键
(4)Q与某非金属原子A形成的晶体结构如图所示。该晶体的化学式是________,与同一个A微粒距离最近的Q微粒有________个。

【答案】 1S22S22P6 N > Cu > K CD CuA 4
【解析】试题X原子的价电子构型为nsnnpn,n=2,所以X是C元素;Y原子的L电子层中,有三个未成对的电子,且无空轨道,电子排布是1S22S22P3,Y是N元素;W、Z的原子序数相差18,且Z原子的第一电离能在同周期中最低,W是H元素、Z是K元素;Q+中所有电子正好充满K.L.M三个电子层,Q是29号元素Cu。
解析:根据以上分析,(1)N3-核外有10个电子,电子排布式是1S22S22P6。
(2)非金属性越强电负性越强,金属性越强电负性越小,所以N、K、Cu电负性由小到大的顺序是N > Cu > K。(3)已知氨气能与Cu2+形成配离子[Cu(NH3)4]2+,该配离子中Cu与 NH3之间是配位键、NH3中存在共价键,所以化学键有CD;(4)根据均摊原则Cu原子数是4,A原子数是![]() ,该晶体的化学式是CuA,根据图示,与同一个A微粒距离最近的Q微粒有4个。
,该晶体的化学式是CuA,根据图示,与同一个A微粒距离最近的Q微粒有4个。


科目:高中化学 来源: 题型:
【题目】在48g碳不完全燃烧所得气体中,CO、CO2均占![]() 体积,且C(s)+
体积,且C(s)+![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1;CO(g)+
O2(g)═CO(g)△H=﹣110.5kJmol﹣1;CO(g)+![]() O2(g)═CO2(g)△H=﹣283kJmol﹣1.与这些碳完全燃烧相比,损失的热量是
O2(g)═CO2(g)△H=﹣283kJmol﹣1.与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJB. 1 149 kJC. 283 kJD. 566 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】成环反应在有机合成中具有重要应用,某环状化合物G的合成过程如下:

(1)A→B为加成反应,则B的结构简式是________;B→C的反应类型是________.
(2)G中含有的官能团名称是___________.
(3)D→E的化学方程式是__________________________反应类型为:__________.
(4)H是F的同分异构体,具有下列结构特征:①核磁共振氢谱除苯环吸收峰外仅有1个吸收峰;②存在甲氧基(CH3O—).H的结构简式是_____________.
(5)由C通过加聚反应合成的高分子化合物M的化学方程式为_______________________.
(6)下列说法正确的是______.
a.A能和HCl反应得到聚氯乙烯的单体 b.D和F中均含有酯基
c.1mol G完全燃烧生成8mol H2O d.F能发生加成反应、取代反应、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBr![]() C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
C2H5Br+H2O,充分反应后达到平衡。已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。下列有关叙述错误的是
A. 加入NaOH,可增大乙醇的物质的量
B. 增大HBr浓度,有利于生成C2H5Br
C. 若反应物增大至2 mol,则两种反应物平衡转化率之比不变
D. 若起始温度提高至60℃,可缩短反应达到平衡的时间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
③取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀;
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如下图所示,

④取少量甲溶液于试管中,加入过最的NaOH溶液并加热。
回答下列问题:
(1)C的元素符号是_______,D在周期表中的位置是________。
(2)经测定甲晶体的摩尔质量为453 gmol-1,其中阳离子和阴离子物质的量之比为1:1,则甲晶体的化学式为________。
(3)实验③中根据图象得V(oa):V(ab):V(bc)= _______。
(4)实验④中离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.B.C.D.E.F六种短期素的原子序数依次增大。已知A.C.F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次处层电子数比最外层电子数多3个。回答下列问题:
(1)写出B元素的符号________,画出E原子的外围电子的轨道表示式________。
(2)写出A.C两种元素最高价氧化物的水化物之间反应的离子方程式________________。最高价氧化物对应水化物的酸性:E________F(填“>”或“<”),写出F的最高价氧化物对应水化物的化学式________
(3)D的固态氧化物的晶体类型是________。
(4)30g的该氧化物的晶体中含D-O键的个数为________mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中加入A、B、C三种气体,保持一定温度,在t1~t4(s) 时刻测得各物质的浓度如下表。下列结论正确的是
测定时刻/s | t1 | t2 | t3 | t4 |
c(A) / (mol·L-1) | 6 | 3 | 2 | 2 |
c(B) / (mol·L-1) | 5 | 3.5 | 3 | 3 |
c(C) / (mol·L-1) | 1 | 2.5 | 3 | 3 |
A. 在t3时刻反应已经停止
B. t3~t4内正、逆反应速率不相等
C. 在容器中发生的反应为A + B![]() C
C
D. 在t2~t3内A的平均反应速率为![]() mol·L-1·s-1
mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是
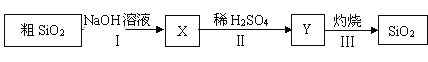
A. X可用作木材防火剂
B. 步骤Ⅱ中的稀硫酸可用CO2来代替
C. 步骤II的反应是Na2SiO3+ H2SO4 = H2SiO3(胶体) + Na2SO4
D. 步骤 Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com