
【题目】

(1)该硫酸的物质的量浓度是____________mol/L。
(2)某化学兴趣小组进行硫酸性质的实验探究时,需用490 mL 4.6 mol/L的稀硫酸,则要量取该硫酸的体积为_____________mL。
(3)按题(2)的要求配制溶液时,右图中肯定不需要用到的实验仪器是________(填仪器序号),所需的玻璃仪器中,除量筒、烧杯、玻璃棒和胶头滴管之外,还需要_______________(填仪器名称)。

(4)在下列配制过程示意图中,有错误的是(填写序号) __________________。

(5)在配制4.6 mol/L的稀硫酸的过程中,下列情况会引起硫酸溶液物质的量浓度偏高的是 。
A.未经冷却趁热将溶液注入容量瓶中 |
B.容量瓶洗涤后,未经干燥处理 |
C.定容时仰视观察液面 |
D.摇匀后发现液面低于刻度线继续加水定容 |
(6)用配制好的4.6 mol/L的稀硫酸溶液,再来配制50ml 1.4mol/L的H2SO4溶液,需要取配好的溶液_______________ml.
【答案】(1)18.4;(2)125.0 ; (3) AC;500mL容量瓶;(4) ①④;(5) A;(6)15.2
【解析】试题分析:(1)c=![]() =
=![]() ="18.4" mol/L,故答案为:18.4;
="18.4" mol/L,故答案为:18.4;
(2)需用490 mL 4.6 mol/L的稀硫酸,应该配制500mL,量取该硫酸的体积=![]() =0.125L=125mL,故答案为:125;
=0.125L=125mL,故答案为:125;
(3) 配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却转移、洗涤转移、定容、摇匀。需要的仪器有量筒、烧杯、玻璃棒和胶头滴管500mL容量瓶,不需要烧瓶和分液漏斗,故答案为:AC;500mL容量瓶;
(4)①稀释浓硫酸应该“酸入水”,错误;②转移溶液进入容量瓶,用玻璃棒引流,正确;③定容时引着玻璃棒注入水,正确;④定容时视线应该水平,错误;错误的是①④,故答案为:①④;
(5)A.未经冷却趁热将溶液注入容量瓶中,导致溶液的体积偏小,浓度偏高,正确;B.容量瓶洗涤后,未经干燥处理,对溶质的物质的量和溶液的体积均无影响,对结果无影响,错误;C.定容时仰视观察液面,导致溶液的体积偏大,浓度偏低,错误;D.摇匀后发现液面低于刻度线继续加水定容,导致溶液的体积偏大,浓度偏低,错误;故选A。
(6)根据稀释前后硫酸的物质的量不变,需要4.6 mol/L的稀硫酸溶液的体积=![]() =0.0152L=15.2mL,故答案为:15.2。
=0.0152L=15.2mL,故答案为:15.2。


科目:高中化学 来源: 题型:
【题目】证明淀粉在酶作用下只部分发生了水解的实验试剂是 ( )
A.碘水 B.氢氧化钠溶液、银氨溶液
C.烧碱溶液、新制Cu(OH)2溶液 D.碘水、烧碱溶液、Cu(OH)2悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A.1 L 1 mol L—1硫酸溶液中所含的氧原子数为4NA
B.标准状况下,11.2 L CC14中所含的原子数为2.5NA
C.2.7 g A1与足量氧气充分反应,转移的电子数为0.3NA
D.常温常压下,14 g由N2与CO组成的混合气体中所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子排布式或运动状态的描述中,不完全是专指碳原子的是( )
A. 原子核外电子有六种运动状态
B. L能层p能级只有一个空轨道
C. L能层有两个未成对的电子
D. 最外层p能级电子数与次外层电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某10% NaOH溶液,加热蒸发掉100g水后得到80mL 20%的溶液,则该20% NaOH溶液的物质的量浓度为( )
A.7 mol/L B.12.5 mol/L C.6.25 mol/L D.7.5 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
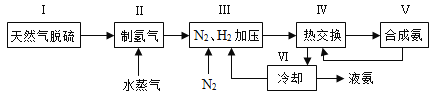
(1)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:____________________。
(2)步骤Ⅱ中制氢气的原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
CO(g)+3H2(g)ΔH=+206.4kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
CO2(g)+H2(g)ΔH=-41.2kJ·mol-1
对于反应①,一定可以提高平衡体系中H2的百分含量,又能加快反应速率的措施是 __。
利用反应②,将CO进一步转化,可提高H2的产量。若1 mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18 mol CO、CO2和H2的混合气体,则CO的转化率为____________。
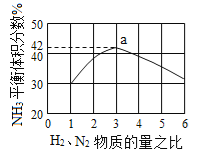
(3)图(a)表示500 ℃、60.0 MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:____________。
(4)上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)_____________。简述本流程中提高合成氨原料总转化率的方法:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2,
②KClO3+6HCl=3Cl2↑+KCl+3H2O,
③2KBrO3+Cl2=Br2+2KClO3,下列说法正确的是
A.上述三个反应都有单质生成,所以都是置换反应
B.氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C.反应②中还原剂与氧化剂的物质的量之比为6∶1
D.③中若有2molCl2反应,则KBrO3得到电子物质的量为2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案以分离KCl和BaCl2两种固体混合物,供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、硫酸、盐酸
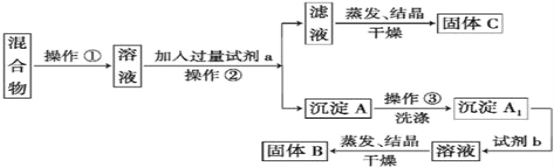
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 (填化学式)。
(3)加入试剂b所发生反应的离子方程式为 。
(4)该方案能否达到实验目的(填能或不能) .若不能,应如何改进(若能,此问不用回答) 。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 。
A、固体C的质量 B、沉淀A的质量
C、沉淀A1的质量(未干燥) D、固体B的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com