

���� ���Ʊ����̿�֪������NaOH��Һ��Ӧ����NaI��NaIO3������Fe��NaIO3����������ԭ��Ӧ����NaI�������������������˺�õ��������������������˺���Һ����Ҫ��NaI��Ũ������ȴ���ᾧ�����롢����ᴿ�õ�NaI��
��1������ǿ�Ӧ�������绯��Ӧ����Ԫ�ػ��ϼ�0�۱仯Ϊ+5�ۺ�-1�ۣ���ϵ����غ������ƽ����Ӧ������������������������������ˮ�����ԭ���غ���ƽ��ѧ����ʽ��
��2�����Ƶýϴ�����NaI����Ũ������ȴʱ��ò�ȡ�Ĵ�ʩ�ǵ�ѹ����Ũ���������뵪������������
��3�����ݵⵥ���������۱���ɫ���ʵ����֤��
��4��2Na2S2O3+I2=Na2S4O6+2NaI����Ϸ�Ӧ������ϵ�������ɵĵⵥ�ʵ�������Ʒ������ȥ�ⵥ�ʵ�����ʣ��ΪKI���������ݴ˼��㴿�ȣ�
��� �⣺��1������ǿ�Ӧ�������绯��Ӧ����Ԫ�ػ��ϼ�0�۱仯Ϊ+5�ۺ�-1�ۣ���ϵ����غ������ƽ�õ����ӷ���ʽΪ��3I2+6OH-=IO3-+5I-+3H2O����Ӧ������Fe��OH��2���ȶ������������������Ӧ��������������Fe��OH��3��������ʱ����Fe2O3����Ӧ���ܷ���ʽΪ4Fe��OH��2+O2$\frac{\underline{\;����\;}}{\;}$2 Fe2O3+4H2O��
�ʴ�Ϊ��5 I-��4Fe��OH��2+O2$\frac{\underline{\;����\;}}{\;}$2 Fe2O3+4H2O��
��2��������NaIΪ��ɫ���壬�ڿ�����ˮ��Һ���������������ƻ��أ����Ƶýϴ�����NaI����Ũ������ȴʱ��ò�ȡ�Ĵ�ʩ�ǵ�ѹ����Ũ���������뵪��������������ֹ�����ӱ���������ѡC��
�ʴ�Ϊ��C��
��3����������������������Ʒ���Ƿ�������ĵ⣨I2���ľ������Ϊ��ȡ������Ӧ�����Һ���Թ��У����뼸�ε�����Һ������Һδ��������֤�����ѷ�Ӧ��ȫ����֮����δ��Ӧ��ȫ������ȡ������Ӧ�����Һ���Թ��У����뼸��CCl4�������ã����²�Һ�����ɫ��֤�����ѷ�Ӧ��ȫ�����²�Һ����Ϻ�ɫ��֤����δ��Ӧ��ȫ����
�ʴ�Ϊ�����Թ��в����뼸�ε�����Һ������Һδ����ɫ��֤��������ȫת������Ʒ��û������⣻�����Һ��������˵����û��ת����ȫ����Ʒ�к�������⣻
��4����ȡm g��Ʒ���ܽⲢ�μӼ��ε�����Һ������a mol•L-1����������ƣ�Na2S2O3������Һ���еζ�����Һ����ɫ��Ϊ��ɫ���������������VmL��
��Ϸ�Ӧ������ϵ�������ɵĵⵥ�ʵ�������Ʒ������ȥ�ⵥ�ʵ�����ʣ��ΪKI������
2Na2S2O3+I2=Na2S4O6+2NaI��
2 1
a mol•L-1��V��10-3L n
n=$\frac{aV}{2}$��10-3mol
�ݴ�NaI���ȵļ���ʽΪ��$\frac{{m-127aV��{{10}^{-3}}}}{m}��100%$
�ʴ�Ϊ��$\frac{{m-127aV��{{10}^{-3}}}}{m}��100%$��
���� ���⿼�������Ʊ�ʵ�飬ע������Ʊ������з����ķ�Ӧ����������Ŀ�漰������ԭ��Ӧ��������ԣ�ע�ػ���֪ʶ�Ŀ��飬��Ŀ�Ѷ��еȣ�


 ��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
��ʦ����ɳ���ʱͬ��ѧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ba��OH��2•8H2O��NH4C1��Ӧ | B�� | ˮ�ⷴӦ | ||
| C�� | ����ĵ��� | D�� | ������NaOH��Һ�ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
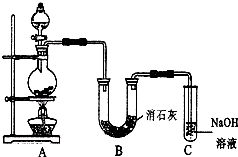 ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư�ۣ�����һ�����ȷ�Ӧ����
ijѧ�������ͼ��ʾ��ʵ��װ�ã����������볱ʪ����ʯ�ҷ�Ӧ��ȡ����Ư�ۣ�����һ�����ȷ�Ӧ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
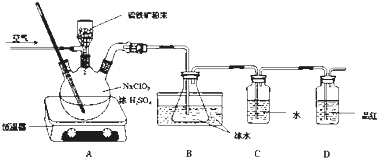
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
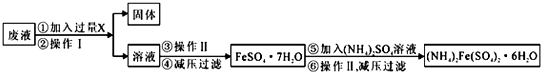
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �۵�/�� | �е�/�� | �ܶ�/g•cm-3 | |
| ������ | -89.53 | 117.25 | 0.81 |
| 1-�嶡�� | -112.4 | 101.6 | 1.28 |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶ȣ�t2���� | �²t2-t1���� | ||
| ���� | NaOH��Һ | ƽ��ֵ | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com