
【题目】下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一项是( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | FeSO4溶液 |
Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
Z | Cl2 | Fe | NaOH溶液 | Cu |
A. A B. B C. C D. D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验。
Ⅰ. 扎西向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色。扎西据此认为此补血剂含铁量很低,属不合格产品。
Ⅱ. 卓玛认为仅凭扎西的证据还不能说明此补血剂不合格,于是她将扎西实验所得溶液分成两份,分别加入了氯水、溴水。发现加入氯水、溴水后溶液呈血红色,颜色明显加深。卓玛据此认为此补血剂是否合格还需要再鉴定。
Ⅲ. 黄妮对扎西做的实验很感兴趣,她向扎西实验所得的淡红色溶液中加入过量铁粉,发现此溶液的浅红色很快褪去。
请根据以上记录回答下列问题:
(1)你认为扎西和卓玛的观点谁正确?__________。
(2)根据卓玛和黄妮的上述实验说明补血剂中的铁应该为____________价。
(3)但扎西直接向补血剂溶液中滴加KSCN溶液,结果显示了淡红色的原因可能是____________________。
(4)请写出卓玛向溶液中加入氯水后所发生的反应的离子反应方程式
______________。
(5)根据卓玛的实验现象可以推断,氯、溴的单质可将铁单质氧化成____________价铁,请写出溴单质与Fe单质在点燃的条件下反应的化学方程式_____________________。
(6)请写出黄妮的实验中使淡红色褪去的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)下列相关说法正确的是 (填序号)。
A.通过某种电池单位质量或单位体积所能输出能量的多少,可以判断该电池的优劣
B.二次电池又称充电电池或蓄电池,这类电池可无限次重复使用
C.除氢气外,甲醇、汽油、氧气等都可用作燃料电池的燃料
D.近年来,废电池必须进行集中处理的问题被提到议事日程,其首要原因是电池外壳的金属材料需要回收
(2)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:
2Ni(OH)2 +Cd(OH)2 ![]() Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O
已知Ni(OH)2 和Cd(OH)2 均难溶于水,但能溶于酸,以下说法正确的是___________。
A.电池放电时Cd作负极 B.反应环境为碱性
C. 以上反应是可逆反应 D.该电池是一种二次电池
(3)在宇宙飞船和其他航天器上经常使用的氢氧燃料电池是一种新型电源,其构造如图所示:a、b两个电极均由多孔的碳块组成,通入的氢气和氧气由孔隙中逸入,并在电极表面发生反应而放电。
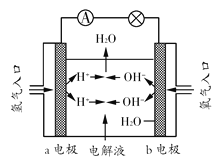
①a电极是电源的________极;
②若该电池为飞行员提供了360kg的水,则电路中通过了________mol电子。
③已知H2的燃烧热为285.8kJ·mol-1,则该燃料电池工作产生36gH2O时,实际上产生了468.8kJ的电能,则该燃料电池的能量转化率是 。(准确到0.01)(能量转化率是实际上释放的电能和理论上反应放出的热能的比率)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol CH4和适量的O2在密闭容器中点燃,充分反应后CH4和O2均无剩余,产物的总质量为72g,且均为气体(101kPa,120℃),下列有关叙述不正确的是
A. 反应中消耗O2 56g
B. 所得产物中各物质的物质的量相等
C. 若将产物通过碱石灰,不能被完全吸收
D. 若将产物通过浓硫酸,充分吸收后,浓硫酸增重36g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中,不正确的是
A. 1mol甲烷中含有4mol C—H共价健
B. CH4、CCl4和CH3Cl都是正四面体结构
C. 光照条件下甲烷能与溴蒸气发生取代反应
D. 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。
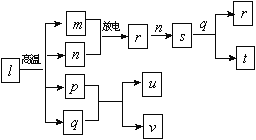
下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________,可燃冰(mCH4·nH2O)属于________晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
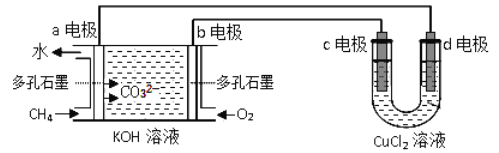
①b电极名称为___________,d电极的电极反应式为_________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。则y=___________。
2NH3(g) △H=-92kJ·mol-1。则y=___________。
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH—)+c(CH3COO—)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH—)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com