
【题目】某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验。
Ⅰ. 扎西向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色。扎西据此认为此补血剂含铁量很低,属不合格产品。
Ⅱ. 卓玛认为仅凭扎西的证据还不能说明此补血剂不合格,于是她将扎西实验所得溶液分成两份,分别加入了氯水、溴水。发现加入氯水、溴水后溶液呈血红色,颜色明显加深。卓玛据此认为此补血剂是否合格还需要再鉴定。
Ⅲ. 黄妮对扎西做的实验很感兴趣,她向扎西实验所得的淡红色溶液中加入过量铁粉,发现此溶液的浅红色很快褪去。
请根据以上记录回答下列问题:
(1)你认为扎西和卓玛的观点谁正确?__________。
(2)根据卓玛和黄妮的上述实验说明补血剂中的铁应该为____________价。
(3)但扎西直接向补血剂溶液中滴加KSCN溶液,结果显示了淡红色的原因可能是____________________。
(4)请写出卓玛向溶液中加入氯水后所发生的反应的离子反应方程式
______________。
(5)根据卓玛的实验现象可以推断,氯、溴的单质可将铁单质氧化成____________价铁,请写出溴单质与Fe单质在点燃的条件下反应的化学方程式_____________________。
(6)请写出黄妮的实验中使淡红色褪去的离子方程式_________________。
【答案】 卓玛 +2或正2价 有部分二价铁离子被氧化成了三价铁离子 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- +3或正3价 2Fe + 3Br2 ![]() 2FeBr3 2Fe3+ + Fe = 3Fe2+
2FeBr3 2Fe3+ + Fe = 3Fe2+
【解析】(1) Ⅰ. 因补血剂的成分是Fe2+,滴加KSCN溶液,溶液显示淡红色,说明Fe3+的浓度低,结论不合理; Ⅱ. 因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价,但含量是否在规定的范围内,还需要进行定量测定,因此结论合理,故答案为:卓玛;
(2) 因加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+,而Fe2+能氧化剂如氯气、液溴所氧化,则原溶液中铁的化合价为+2价,故答案为:+2;
(3) 因Fe2+氧化生成Fe3+,Fe3+遇SCN-变红,所以向补血剂溶液中滴加KSCN溶液,显示淡红色的原因有少量的亚铁离子被氧化,故答案为:有少量的亚铁离子被氧化;
(4) 因Fe2+与Cl2反应生成Fe3+和Cl-:Cl2+2Fe2+=2Cl-+2Fe3+,故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(5) 根据加入氯水、溴水后溶液呈血红色,颜色明显加深,说明生成更多的Fe3+;溴单质与Fe单质在点燃的条件下反应的化学方程式为2Fe + 3Br2 ![]() 2FeBr3,故答案为:+3;2Fe + 3Br2
2FeBr3,故答案为:+3;2Fe + 3Br2 ![]() 2FeBr3;
2FeBr3;
(6)黄妮的实验中铁能够将铁离子还原为亚铁离子,使淡红色褪去,反应的离子方程式为2Fe3+ + Fe = 3Fe2+,故答案为:2Fe3+ + Fe = 3Fe2+。


科目:高中化学 来源: 题型:
【题目】下列各化合物中,均为弱电解质的一组是
A. H2CO3 Ba(OH)2 K2S H3PO4 B. FeCl3 HCl C2H5OH NH4Cl
C. CH3COOH H2CO3 Cu(OH)2 H2O D. HCl KNO3 H2CO3 H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH4+)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH4+)。
(2)如图是0.1 mol·L-1该溶液pH随温度变化的图像。

①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写字母),导致pH随温度变化的原因是_______________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)≈________。(用具体数值表示)
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
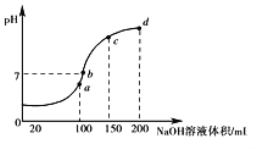
试分析图中a、b、c、d四个点,水的电离程度最大是________;在b点,溶液中各离子浓度由大到小的排列顺序是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+![]() AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是( )
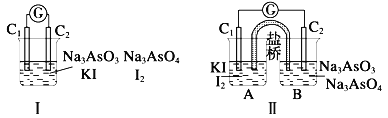
A.甲组操作时,微安表(G)指针发生偏转
B.甲组操作时,溶液颜色变深
C.乙组操作时,C1上发生的电极反应为I2+2e-═2I-
D.乙组操作时,C2做正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,X是主体物质,Y是少量杂质,Z是为除去杂质所要加入的试剂,其中所加试剂正确的一项是( )
A | B | C | D | |
X | FeCl2溶液 | FeCl3溶液 | Fe | FeSO4溶液 |
Y | FeCl3 | CuCl2 | Al | Fe2(SO4)3 |
Z | Cl2 | Fe | NaOH溶液 | Cu |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
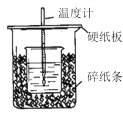
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________。
(2)烧杯间填满碎纸条的作用是_____________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)
(4)该同学所用的装置,有一处明显不合理,请你说明不合理之处:____________________。
(5)在实验过程中,该同学没有找到缺少的那一件用品,就用铁丝自己做了一个,你认为______(填“是、否)可以,请说明原因_____________________。
(6)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量_________(填“相等”或“不相等”)。
(7)用相同浓度和体积的醋酸(CH3COOH)代替盐酸溶液进行上述实验,测得的中和热的数值会___________;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com