
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
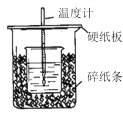
(1)从实验装置上看,图中尚缺少的一种玻璃用品是_____________________。
(2)烧杯间填满碎纸条的作用是_____________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________(填“偏大、偏小、无影响”)
(4)该同学所用的装置,有一处明显不合理,请你说明不合理之处:____________________。
(5)在实验过程中,该同学没有找到缺少的那一件用品,就用铁丝自己做了一个,你认为______(填“是、否)可以,请说明原因_____________________。
(6)实验中改用60 mL 0.50 mol·L-1的盐酸跟50 mL 0.55 mol·L-1的NaOH溶液进行反应,与上述实验相比,所求中和热_________ (填“相等”或“不相等”),所放出的热量_________(填“相等”或“不相等”)。
(7)用相同浓度和体积的醋酸(CH3COOH)代替盐酸溶液进行上述实验,测得的中和热的数值会___________;(填“偏大”、“偏小”、“无影响”)。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 两烧杯口没有在同一水平面 否 铁是热的良导体,用铁丝作搅拌棒,会增大实验误差 相等 不相等 偏小
【解析】考查中和热的测定,△H=-cm(t1-t0)/n(H2O),(1)根据中和热的测定,缺少的玻璃仪器是环形玻璃搅拌棒;(2)中和热的测定,需要减少热量损失,因此碎纸条的目的保温,减少实验过程中的热量损失;(3)大烧杯上如不盖硬纸板,造成热量损失,t1减少,因此中和热数值减小;(4)两烧杯口没有在同一水平面,造成热量损失,所测数值偏小;(5)铁丝是热的良导体,造成热量损失,即铁是热的良导体,用铁丝作搅拌棒,会增大实验误差,因此不能用铁丝代替环形玻璃搅拌棒;(6)中和热是稀酸和稀碱反应生成1molH2O时放出的热量,与所加物质的量无关,即中和热相等,放出热量不相等;(7)醋酸是弱电解质,电离吸收热量,造成所测中和热数值偏小。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组为探究某医药公司出品的液体补血剂中的铁元素,进行了如下实验。
Ⅰ. 扎西向试管中加入液体补铁剂2mL,加入蒸馏水,振荡后发现溶液变澄清透明;滴加KSCN溶液,溶液显示淡红色。扎西据此认为此补血剂含铁量很低,属不合格产品。
Ⅱ. 卓玛认为仅凭扎西的证据还不能说明此补血剂不合格,于是她将扎西实验所得溶液分成两份,分别加入了氯水、溴水。发现加入氯水、溴水后溶液呈血红色,颜色明显加深。卓玛据此认为此补血剂是否合格还需要再鉴定。
Ⅲ. 黄妮对扎西做的实验很感兴趣,她向扎西实验所得的淡红色溶液中加入过量铁粉,发现此溶液的浅红色很快褪去。
请根据以上记录回答下列问题:
(1)你认为扎西和卓玛的观点谁正确?__________。
(2)根据卓玛和黄妮的上述实验说明补血剂中的铁应该为____________价。
(3)但扎西直接向补血剂溶液中滴加KSCN溶液,结果显示了淡红色的原因可能是____________________。
(4)请写出卓玛向溶液中加入氯水后所发生的反应的离子反应方程式
______________。
(5)根据卓玛的实验现象可以推断,氯、溴的单质可将铁单质氧化成____________价铁,请写出溴单质与Fe单质在点燃的条件下反应的化学方程式_____________________。
(6)请写出黄妮的实验中使淡红色褪去的离子方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在下图所示物质转化关系中,l是由该四种元素组成的离子化合物,m是Y的单质,n是Z的单质,m、n均为空气的主要成分,p是W的单质,其余为由上述的两种或三种元素组成的化合物;u的水溶液具有漂白性;t和v均为一元强酸。
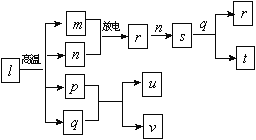
下列说法正确的是
A. 物质u中既含共价键又含离子键
B. 常温常压下,r与s均为无色气体
C. 简单气态氢化物的热稳定性:Z
D. X、Y、Z三种元素形成化合物的水溶液可能呈酸性,也可能呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。
(1)天然气和可燃冰(mCH4·nH2O)既是高效洁净的能源,也是重要的化工原料,
①甲烷分子的空间构型为__________,可燃冰(mCH4·nH2O)属于________晶体。
②已知25℃、101kPa时,1g甲烷完全燃烧生成液态水放出55.65kJ热量,则该条件下反应
CH4(g)+2O2(g)=CO2(g)+2H2O(l)的△H=______kJ·mol-1
(2)用甲烷-氧气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。反应装置如下图所示:
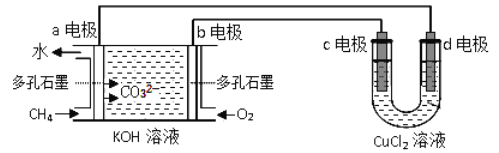
①b电极名称为___________,d电极的电极反应式为_________。
②假设CuCl2溶液足量,当某电极上析出3.2g金属Cu时,理论上燃料电池消耗氧气在标准状况下的体积是______ mL。
(3)在相同条件下,下面各组热化学方程式中,△H1<△H2的是________。(填字母)
A组:2H2(g)+O2(g)=2H2O(g) △H1 2H2(g)+O2(g)═2H2O(l) △H2
B组:S(g)+O2(g)=SO2(g) △H1 S(s)+O2(g)=SO2(g) △H2
C组:C(s)+1/2O2(g)=CO(g) △H1 C(s)+O2(g)=CO2(g) △H2
D组:CO(g)+1/2O2(g)=CO2(g) △H1 2CO(g)+O2(g)=2CO2(g) △H2
(4)25℃,10lkPa条件下,14gN2和3gH2应生成NH3的能量变化如下图所示:

己知:①x=1127;
②25℃101kPa下,N2(g)+3H2(g)![]() 2NH3(g) △H=-92kJ·mol-1。则y=___________。
2NH3(g) △H=-92kJ·mol-1。则y=___________。
(5)金属材料的腐蚀是人类面临的严重问题,金属的防腐对节约能源、保护环境起着十分重要的作用。下列三个装置中,铁被腐蚀速率由快到慢的顺序为_________(填字母)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在FeCl3、CuCl2和HCl的混合溶液中加入铁粉,待反应结束后,将剩余的固体滤出,发现固体能被磁铁吸引,则反应后溶液中大量存在的阳离子是
A. Fe2+ B. H+ C. Cu2+和Fe2+ D. Fe3+和Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的名称或俗名与化学式相对应的
A. 小苏打——Na2CO3 B. 火碱——Na2O2
C. 磁性氧化铁——Fe2O3 D. 醋酸——CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH ![]() H++CH3COO-,下列叙述不正确的是( )
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH—)+c(CH3COO—)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH—)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.将等物质的量的X、Y的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下发生可逆反应。下列说法正确的是
A. 达到化学平衡时,正反应速率与逆反应速率不相等
B. 反应过程中,Y的单质的体积分数始终为50%
C. 达到化学平衡时,X、Y的两种单质在混合气体中的物质的量之比为1:1
D. 达到化学平衡的过程中,混合气体平均相对分子质量逐渐减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com