
【化学—选修2:化学与技术】(15分)
请回答氯碱工业的如下问题:
 (1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=_______(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)③BaCl2,这3种试剂添加的合理顺序是______________(填序号)
 (3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X是__ ___(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
 ②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
②分别写出燃料电池B中正极、负极上发生的电极反应正极:______; 负极:_____;
③这样设计的主要节(电)能之处在于(写出2处)____________、____________。
(15分)(1)k=M(Cl2)/2 M(NaOH)=71/80=1:1.13或0.89(2分)
(2)③①②(2分) (3)①Cl2 (1分) a%小于b% (2分)
②O2+4e-+2H2O=4OH- (2分) H2-2e-+2OH-=2H2O (2分)
③燃料电池可以补充电解池消耗的电能(2分));提高产出碱液的浓度(2分;降低能耗(其他合理答案也给分)
【解析】(1)惰性电极电解饱和食盐水的方程式为2NaCl+2H2O 2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
2NaOH+H2↑+Cl2, ↑,根据方程式可知氯气和氢氧化钠的物质的量之比是1︰2,所以质量之比是)k=M(Cl2)/2 M(NaOH)=71/80=0.89。
(2)由于除去SO42-时要加入过量的氯化钡溶液,而过量的氯化钡需要碳酸钠除去,所以正确的操作顺序是③①②。
(3)①由于在燃料电池中失去电子的是氢气,所以Y是氢气,则X就是氯气。由于燃料电池中的离子膜只允许阳离子通过,而燃料电池中正极氧气得到电子产生OH-,所以反应后氢氧化钠的浓度升高,即a%小于b%。
②负极是氢气失去电子,正极氧气得到电子,所以电极反应式分别为H2-2e-+2OH-=2H2O 、O2+4e-+2H2O=4OH- 。
③根据装置特点及反应过程可知,这样设计的优点是燃料电池可以补充电解池消耗的电能;提高产出碱液的浓度;降低能耗等。


科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2012届宁夏银川一中高三第三次模拟考试化学试卷(带解析) 题型:填空题
【化学-选修2:化学与技术】(15分)
水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。请回答下列问题:
(1)天然水中溶解的气体主要有__________、__________。
(2)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是_____。
(3)水的净化和软化的区别是__________。
(4)硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)。若某天然
水中c(Ca2)=1.2×10-3mol/L,c(Mg2+)=6×10-4mol/L,则此水的硬度为
_________。
(5)若(4)中的天然水还含有c(HCO3-)=8×10-4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2__________g,后加入Na2CO3___________g。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省唐山市高三上学期期末统一考试理综试题化学试卷(解析版) 题型:选择题
【化学——选修2:化学与技术】(15分)碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:

已知:①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。

(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。
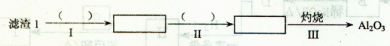
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com