
| A.与NaOH反应的氯气一定为0.3 mol |
| B.反应后的溶液中n(Na+):n(Cl-)可能为7:3 |
| C.若反应中转移的电子为n mol,则0.15<n<0.25 |
| D.n(NaCl):n(NaClO):n(NaClO3)可能为11﹕2﹕1 |


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.M+ | B.M2+ | C.M3+ | D.MO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。
4NH3 (g)+3O2 (g) - Q ,如果反应的平衡常数K值变大,该反应 (选填编号)。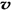 (N2)/
(N2)/ 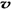 (O2)=2:3
(O2)=2:3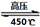 6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。
6H2O↑+ 2N2↑+ 4HCl↑+ 5O2↑,其中氧化产物与还原产物的物质的量之比是 ,每分解1mol高氯酸铵,转移的电子数目是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.+4 | B.+7 | C.+6 | D.+5 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3.2mol/L | B.2.8mol/L | C.1.8mol/L | D.缺数据无法计算 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2,4,3,2,2,6 | B.0,2,1,0,1,2 |
| C.2,0,1,2,0,2 | D.2,8,5,2,4,10 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com