
 CO2��g����H2��g��
CO2��g����H2��g��  H=-41��16kJ��mol�����ڸ÷�Ӧ�йر�����ȷ���� ��
H=-41��16kJ��mol�����ڸ÷�Ӧ�йر�����ȷ���� �� H 0����������������Ӻϳ����ڳ������������Ժ���һ������CO2��NH3��Ӧ��δ��� ��
H 0����������������Ӻϳ����ڳ������������Ժ���һ������CO2��NH3��Ӧ��δ��� ��
 ��
��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A�����ܡ����ܡ��������ܵ����ڿ�������Դ |
| B���ƹ��������Դ�����ھ��ÿɳ�����չ |
| C����ͼ��̫���ܹ�����ԭ��ͼ��ͼ��A��Ϊ���� |
| D������������ת����ʽ��̫����ֱ��ת����Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��������¯�ĸ߶Ȳ��� | B��CO������ʯ�Ӵ������ |
| C��CO���� | D��CO��Fe2O3�ķ�Ӧ��һ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����̼��ȼ�����æ�H3����ʾ����H3<��H1 |
| B����̼��ȼ�����æ�H3����ʾ����H3>��H1 |
| C��Ũ������ϡNaOH��Һ��Ӧ���к���Ϊ��57.3 kJ/mol |
| D��ϡ������ϡNaOH��Һ��Ӧ����1 molˮ���ų�57.3 kJ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
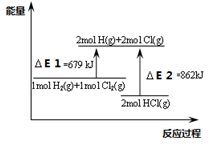
| A����E1�Ǹ÷�Ӧ�Ļ�� |
| B����E2���ƻ�2mol HCl(g)��������� |
| C���÷�Ӧ���Ȼ�ѧ����ʽΪH2+Cl2��2 HCl��H����183KJ/mol |
| D���÷�Ӧ��һ����Ӧ�������������������������ķ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����Ҫ���Ȳ��ܷ����ķ�Ӧһ�������ȷ�Ӧ |
| B���κη��ȷ�Ӧ�ڳ���������һ���ܷ�����Ӧ |
| C����Ӧ��������������е������������˷��Ȼ������� |
| D��C(ʯī��s)=C(���ʯ��s)��H>0�����Խ��ʯ��ʯī�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��C��s����O2��g��="==CO(g)" ��H ="��110.5" kJ/mol |
| B��C��s����O2��g��===CO2(g) ��H =��393.5 kJ/mol |
| C��2H2(g)��O2(g)===2H2O(l) ��H =��571.6 kJ/mol |
| D��H2(g)��1/2O2(g)===H2O(g) ��H =��241.8 kJ/mol |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com