
ЎѕМвДїЎїПВГжКЗФЄЛШЦЬЖЪ±нµДТ»Ії·ЦЈ¬ІОХХўЩЎ«ўаФЄЛШФЪ±нЦРµДО»ЦГЈ¬ЗлУГ»ЇС§УГУп»ШґрПВБРОКМвЈє
ЦЬЖЪ/ЦчЧе | ўсA | ўтA | ўуA | ўфA | ўхA | ўцA | ўчA | 0Че |
1 | ўЩ | |||||||
2 | ўЪ | ўЫ | ўЬ | |||||
3 | ўЭ | ўЮ | ўЯ | ўа | ўб |
ЈЁ1Ј©ўЬЎўўЭЎўўаИэЦЦФЄЛШЦРЈ¬АлЧУ°лѕ¶ґуРЎµДЛіРтОЄ__________ЈЁМоАлЧУ·ыєЕЈ©ЎЈ
ЈЁ2Ј©ўЪЎўўЯЎўўаµДЧоёЯјЫє¬СхЛбµДЛбРФУЙЗїµЅИхµДЛіРтКЗ_________ЈЁМо»ЇС§КЅЈ©ЎЈ
ЈЁ3Ј©ўЮµҐЦКУлўЭµДЧоёЯјЫСх»ЇОпµДЛ®»ЇОп·ґУ¦µДАлЧУ·ЅіМКЅОЄЈє_____________ЎЈ
ЈЁ4Ј©ДЬЛµГчўаµД·ЗЅрКфРФ±ИўбµД·ЗЅрКфРФ_________ЈЁМоЎ°ЗїЎ±»тЎ°ИхЎ±Ј©µДКВКµКЗ____________________________ЈЁУГАлЧУ·ЅіМКЅЛµГчЈ©ЎЈ
ЈЁ5Ј©ўЩєНўЫРОіЙµД18µзЧУµД»ЇєПОпјЧКЗТ»ЦЦУ¦УГ№г·єµД»Ї№¤ФБПЈ¬РґіцјЧµДµзЧУКЅЈє_________Ј¬КµСйКТЦРїЙУГґОВИЛбДЖИЬТєУл°±·ґУ¦ЦЖ±ёјЧЈ¬·ґУ¦µД»ЇС§·ЅіМКЅОЄЈє____________________________ЎЈ
Ўѕґр°ёЎїS2-ЈѕO2-ЈѕNa+ H2SO4ЈѕH2CO3ЈѕH2SiO3 2Al + 2OH- + 2H2O = 2Al02- + 3H2Ўь Их Cl2 + S2- = 2Cl- + SЎэЈЁ»тЖдЛыєПАнґр°ёЈ© 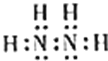 2NH3 + NaClO = N2H4 + NaCl + H2O
2NH3 + NaClO = N2H4 + NaCl + H2O
ЎѕЅвОцЎї
ёщѕЭФЄЛШФЪЦЬЖЪ±нЦРµДО»ЦГїЙЦЄЈєўЩОЄHЈ¬ўЪОЄCЈ¬ўЫОЄNЈ¬ўЬОЄOЈ¬ўЭОЄNaЈ¬ўЮОЄAlЈ¬ўЯОЄSiЈ¬ўаОЄSЈ¬ўбОЄClЈ¬ѕЭґЛ·ЦОцЎЈ
ёщѕЭФЄЛШФЪЦЬЖЪ±нЦРµДО»ЦГїЙЦЄЈєўЩОЄHЈ¬ўЪОЄCЈ¬ўЫОЄNЈ¬ўЬОЄOЈ¬ўЭОЄNaЈ¬ўЮОЄAlЈ¬ўЯОЄSiЈ¬ўаОЄSЈ¬ўбОЄClЎЈ
ЈЁ1Ј©ўЬЎўўЭЎўўаИэЦЦФЄЛШЦРЈ¬S2-¶аТ»ёцµзЧУІгЈ¬АлЧУ°лѕ¶ЧоґуЈ¬O2-ЎўNa+ѕЯУРПаН¬µзЧУІгЅб№№Ј¬єЛµзєЙКэґуµД°лѕ¶РЎЈ¬ФтАлЧУ°лѕ¶ґуРЎµДЛіРтОЄS2-ЈѕO2-ЈѕNa+Ј»
ЈЁ2Ј©ФЄЛШ·ЗЅрКфРФФЅЗїЈ¬ЖдЧоёЯјЫє¬СхЛбµДЛбРФФЅЗїЈ¬ўЪЎўўЯЎўўаµД·ЗЅрКфРФSЈѕCЈѕSiЈ¬ФтЧоёЯјЫє¬СхЛбµДЛбРФУЙЗїµЅИхµДЛіРтКЗH2SO4ЈѕH2CO3ЈѕH2SiO3Ј»
ЈЁ3Ј©ўЮµҐЦКAlУлўЭµДЧоёЯјЫСх»ЇОпµДЛ®»ЇОпNaOH·ґУ¦µДАлЧУ·ЅіМКЅОЄЈє2Al + 2OH- + 2H2O = 2AlO2- + 3H2ЎьЈ»
ЈЁ4Ј©»№ФРФЈєCl-ЈјS2-Ј¬Фт·ЗЅрКфРФClЈѕSЈ¬ДЬЛµГчВИФЄЛШµД·ЗЅрКфРФ±ИБтФЄЛШЗїЈ¬№КДЬЛµГчўаµД·ЗЅрКфРФ±ИўбµД·ЗЅрКфРФИхµДКВКµКЗCl2 + S2- = 2Cl- + SЎэЈ»
ЈЁ5Ј©ўЩєНўЫРОіЙµД18µзЧУµД»ЇєПОпјЧµД·ЦЧУКЅОЄN2H4Ј¬јЧµДµзЧУКЅОЄ![]() Ј¬КµСйКТЦРїЙУГґОВИЛбДЖИЬТєУл°±·ґУ¦ЦЖ±ёјЧЈ¬Н¬К±ЙъіЙВИ»ЇДЖєНЛ®Ј¬·ґУ¦µД»ЇС§·ЅіМКЅОЄЈє2NH3 + NaClO = N2H4 + NaCl + H2OЎЈ
Ј¬КµСйКТЦРїЙУГґОВИЛбДЖИЬТєУл°±·ґУ¦ЦЖ±ёјЧЈ¬Н¬К±ЙъіЙВИ»ЇДЖєНЛ®Ј¬·ґУ¦µД»ЇС§·ЅіМКЅОЄЈє2NH3 + NaClO = N2H4 + NaCl + H2OЎЈ



| Дкј¶ | ёЯЦРїОіМ | Дкј¶ | іхЦРїОіМ |
| ёЯТ» | ёЯТ»Гв·СїОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СїОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СїОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СїОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СїОіМНЖјцЈЎ | іхИэ | іхИэГв·СїОіМНЖјцЈЎ |
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЈЁ1Ј©Пт1L1mol/LµДNaOHИЬТєЦРјУИлПВБРОпЦКЈєўЩЕЁH2SO4Ј»ўЪПЎПхЛбЈ»ўЫПЎґЧЛбЈ¬ЗЎєГНкИ«·ґУ¦µДИИР§У¦ОЄЎчH1ЎўЎчH2ЎўЎчH3 Ј¬ ФтИэХЯУЙРЎµЅґуЛіРтОЄ________
ЈЁ2Ј©УЙёЗЛ№¶ЁВЙЅбєППВКц·ґУ¦·ЅіМКЅЈ¬»ШґрОКМвЈє
ўЩNH3ЈЁgЈ©+HClЈЁgЈ©ЁTNH4ClЈЁsЈ©ЎчH=©Ѓ176kJ/mol
ўЪNH3ЈЁgЈ©+H2OЈЁlЈ©ЁTNH3H2OЈЁaqЈ©ЎчH=©Ѓ35.1kJ/mol
ўЫHClЈЁgЈ©+H2OЈЁlЈ©ЁTHClЈЁaqЈ©ЎчH=©Ѓ72.3kJ/mol
ўЬNH3H2OЈЁaqЈ©+HClЈЁaqЈ©ЁTNH4ClЈЁaqЈ©ЎчH=©Ѓ52.3kJ/mol
ФтNH4ClЈЁsЈ©+2H2OЈЁlЈ©ЁTNH4ClЈЁaqЈ©ЖдЎчHµИУЪ_________ kJ/molЈ®
ЈЁ3Ј©ёщѕЭПВБРИИ»ЇС§·ЅіМКЅ·ЦОцЈ¬РґіцCЈЁsЈ©ИјЙХИИµДИИ»ЇС§·ЅіМКЅ________
CЈЁsЈ©+H2OЈЁlЈ©ЁTCOЈЁgЈ©+H2ЈЁgЈ©ЎчH1=+175.3kJmol©Ѓ1
2COЈЁgЈ©+O2ЈЁgЈ©ЁT2CO2ЈЁgЈ©ЎчH2=©Ѓ566.0kJmol©Ѓ1
2H2ЈЁgЈ©+O2ЈЁgЈ©ЁT2H2OЈЁlЈ©ЎчH3=©Ѓ571.6kJmol©Ѓ1 Ј®
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЖПМСКЗТ»ЦЦіЈјыЛ®№ыЈ¬їЙТФЙъКі»тЦЖЧчЖПМСёЙЈ¬іэґЛЦ®НвЈ¬ЖПМС»№їЙУГУЪДрѕЖЎЈ
(1)јмСйЖПМСЦє¬УРЖПМСМЗµД·Ѕ·ЁКЗЈєПтЖдЦРјУјоµчЦБјоРФЈ¬ФЩјУИлРВЦЖµДCu(OH)2ІўјУИИЈ¬ЖдПЦПуКЗ________ЎЈ
(2)ЖПМСФЪДрѕЖ№эіМЦРЈ¬ЖПМСМЗЧЄ»ЇОЄѕЖѕ«µД№эіМИзПВЈ¬І№ідНкіЙПВБР»ЇС§·ЅіМКЅЈєC6H12O6(ЖПМСМЗ)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)ЖПМСѕЖГЬ·вґўґж№эіМЦР»бЙъіЙУРПгО¶µДхҐАаЈ¬хҐАаТІїЙТФНЁ№э»ЇС§КµСйАґЦЖ±ёЈ¬КµСйКТїЙУГИзНјЛщКѕЧ°ЦГЦЖ±ёТТЛбТТхҐЈє

ўЩКФ№ЬaЦРЙъіЙТТЛбТТхҐµД»ЇС§·ЅіМКЅКЗ__________ЎЈ
ўЪКФ№ЬbЦРКў·ЕµДКФјБКЗ±ҐєН____________ИЬТєЎЈ
ўЫКµСйїЄКјК±Ј¬КФ№ЬbЦРµДµј№ЬІ»ЙмИлТєГжПВµДФТтКЗ________ЎЈ
ўЬИфТЄ·ЦАліцКФ№ЬbЦРµДТТЛбТТхҐЈ¬РиТЄУГµЅµДТЗЖчКЗ_______(МоЧЦДё)ЎЈ
A.ЖХНЁВ©¶· B.·ЦТєВ©¶· C.і¤ѕ±В©¶·
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТ»¶ЁМхјюПВЈ¬ФЪГЬ±ХИЭЖч·ўЙъїЙДж·ґУ¦Јє4NH3(g)+5O2(g) ![]() 4NO(g) +6H2O (g)Ј¬ПВБРЛµ·ЁДЬід·ЦЛµГчёГ·ґУ¦ТСѕґпµЅ»ЇС§ЖЅєвЧґМ¬µДКЗ( )
4NO(g) +6H2O (g)Ј¬ПВБРЛµ·ЁДЬід·ЦЛµГчёГ·ґУ¦ТСѕґпµЅ»ЇС§ЖЅєвЧґМ¬µДКЗ( )
A. ХэДж·ґУ¦ЛЩВКПаµИЗТµИУЪБг
B. NH3ЎўO2ЎўNOєНH2OЕЁ¶ИѕщПаµИ
C. NH3ЎўO2ЎўNOєНH2OФЪИЭЖчЦР№Іґж
D. NH3ЎўO2ЎўNOєНH2OЕЁ¶ИІ»ФЩ·ўЙъ±д»Ї
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїПВБРРрКцЦРХэИ·µДУР
ўЩ![]() ёГФЧУµДµзЧУЕЕІјНјЈ¬ЧоНвІгОҐ±іБЛєйМШ№жФт
ёГФЧУµДµзЧУЕЕІјНјЈ¬ЧоНвІгОҐ±іБЛєйМШ№жФт
ўЪґ¦УЪЧоµНДЬБїЧґМ¬ФЧУЅР»щМ¬ФЧУЈ¬1s22s22px1Ўъ1s22s22py1№эіМЦРРОіЙµДКЗ·ўЙд№вЖЧ
ўЫФЛУГјЫІгµзЧУ¶Ф»ҐівАнВЫЈ¬CO32-АлЧУµДїХјд№№РНОЄИэЅЗЧ¶РН
ўЬѕЯУРПаН¬єЛНвµзЧУЕЕІјµДБЈЧУЈ¬»ЇС§РФЦКПаН¬
ўЭNCl3ЦРN-ClјьµДјьі¤±ИCCl4ЦРC-ClјьµДјьі¤¶М
A.1ёц
B.2ёц
C.3ёц
D.4ёц
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїіЈОВПВЈ¬УГ0.1molL-1µД°±Л®µО¶Ё10.00 mL0.1molL-1µДЛбHAИЬТєЈ¬ЛщјУ°±Л®µДМе»эЈЁVЈ©УлИЬТєЦРlg 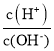 µД№ШПµИзНјЛщКѕЎЈПВБРЛµ·ЁІ»ХэИ·µДКЗ
µД№ШПµИзНјЛщКѕЎЈПВБРЛµ·ЁІ»ХэИ·µДКЗ
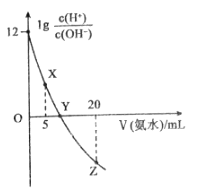
A.ИЬТєЦРЛ®µДµзАліМ¶ИXЈјYЈјZ
B.XµгЈєcЈЁA-Ј©ЈѕcЈЁH+Ј©ЈѕcЈЁNH4+Ј©ЈѕcЈЁOH-Ј©
C.YµгЈєVЈЁ°±Л®Ј©Јј10.00mL
D.ZµгЈє2cЈЁH+Ј©+cЈЁNH4+Ј©=2cЈЁOH-Ј©+cЈЁNH3H2OЈ©
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїТСЦЄЈє2H2O(l)=2H2(g)Ј«O2(g) ¦¤HЈЅЈ«571.0kJ/molЎЈТФМ«СфДЬОЄИИФґ·ЦЅвFe3O4Ј¬ѕИИ»ЇС§МъСх»ЇєПОпС»··ЦЅвЛ®ЦЖH2µД№эіМИзПВЈє
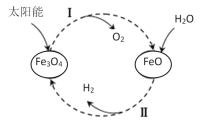
№эіМўсЈє2Fe3O4(s)=6FeO(s)Ј«O2(g) ¦¤HЈЅЈ«313.2kJ/mol
№эіМўтЈєЎЎ
ПВБРЛµ·ЁІ»ХэИ·µДКЗЈЁ Ј©
A.№эіМўсЦРГїПыєД232gFe3O4ЧЄТЖ2molµзЧУ
B.№эіМўтИИ»ЇС§·ЅіМКЅОЄЈє3FeO(s)Ј«H2O(l)=H2(g)Ј«Fe3O4(s) ¦¤HЈЅЈ128.9kJ/mol
C.№эіМўсЎўўтЦРДЬБїЧЄ»ЇµДРОКЅТАґОКЗЈєМ«СфДЬЎъ»ЇС§ДЬЎъИИДЬ
D.МъСх»ЇєПОпС»·ЦЖH2ѕЯУРіЙ±ѕµНЎўІъОпТЧ·ЦАлµИУЕµг
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїФЧУРтКэТАґОФцјУµДXЎўYЎўZЎўWЛДЦЦФЄЛШФЧУРтКэѕщРЎУЪ36Ј¬Y»щМ¬ФЧУЧоНвІгµзЧУКэКЗЖдДЪІгµзЧУЧЬКэµД3±¶Ј¬XЎўW»щМ¬ФЧУКЗН¬ЦЬЖЪФЄЛШЦРОґіЙ¶ФµзЧУКэЧо¶аµДФЧУЈ¬XУлZµДФЧУєЛДЪЦКЧУКэЦ®єНµИУЪWФЧУєЛДЪЦКЧУКэЈ¬Z»щМ¬ФЧУЦ»УР1ёцОґіЙ¶ФµДµзЧУЎЈ»ШґрПВБРОКМвЈє
(1)ТСЦЄ»ЇєПОпXZ3УлH2YЈЁYµДЗв»ЇОпЈ©·ўЙъ·ґУ¦µД»ЇС§·ЅіМКЅОЄXZ3Ј«H2YЎъXH3Ј«HZYЈ¬ФтФЄЛШµДµзёєРФЈєY______ZЈЁМоЎ°ґуУЪЎ±»тЎ°РЎУЪЎ±Ј©Ј¬»ЇєПОпHZY·ЦЧУµДїХјд№№РНОЄ______ЎЈ
(2)XµДТ»ЦЦЗв»ЇОпµДПа¶Ф·ЦЧУЦКБїОЄ32Ј¬1molёГЗв»ЇОпЦРµД¦ТјьКэКЗ______ЎЈ
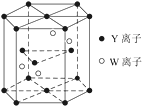
(3)ўЩФЄЛШYµДТ»ЦЦµҐЦК·ЦЧУУлФЄЛШXЎўYРОіЙµДТ»ЦЦАлЧУ»ҐОЄµИµзЧУМеЈ¬ХвБЅЦЦОўБЈµД»ЇС§КЅКЗ_______Ўў________ЎЈ
ўЪ»щМ¬WФЧУµДµзЧУЕЕІјКЅКЗ_______________ЎЈ
(4)ФЄЛШYєНWµДТ»ЦЦ»ЇєПОпµДѕ§МеЅб№№ИзНјЛщКѕЈ¬ёГѕ§МеµД»ЇС§КЅОЄ______Ј»ЅрКфФЧУ______ЈЁСЎМоЎ°јШЎ±ЎўЎ°ГѕЎ±ЎўЎ°НЎ±Ј©РОіЙµДѕ§МеµД¶С»э·ЅКЅЈ¬УлЙПКцѕ§°ыЦРYАлЧУµД¶С»э·ЅКЅПаН¬ЎЈ
Ійїґґр°ёєНЅвОц>>
їЖДїЈєёЯЦР»ЇС§ АґФґЈє МвРНЈє
ЎѕМвДїЎїЙиNAОЄ°ў·ьјУµВВЮіЈКэµДЦµЈ¬ПВБРЛµ·ЁХэИ·µДКЗЈЁ Ј©
A.0.1molNa2O2ЦРТхАлЧУµДКэДїОЄ0.2NA
B.1L0.1mol/LµДHFИЬТєЦРFЈКэДїОЄ0.1NA
C.0.1molFeФЪµгИјМхјюПВУлСхЖш·ґУ¦К±ЧЄТЖµзЧУКэДїОЄ0.3NA
D.0.4molЕЁСОЛбУлЧгБїµДMnO2јУИИід·Ц·ґУ¦Ј¬ІъЙъCl2µДКэДїРЎУЪ0.1NA
Ійїґґр°ёєНЅвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБР±н - КФМвБР±н
єю±±КЎ»ҐБЄНшОҐ·ЁєНІ»БјРЕПўѕЩ±ЁЖЅМЁ | НшЙПУРє¦РЕПўѕЩ±ЁЧЁЗш | µзРЕХ©ЖѕЩ±ЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРє¦РЕПўѕЩ±ЁЧЁЗш | ЙжЖуЗЦИЁѕЩ±ЁЧЁЗш
ОҐ·ЁєНІ»БјРЕПўѕЩ±Ёµз»°Јє027-86699610 ѕЩ±ЁУКПдЈє58377363@163.com