
【题目】常温下,将NaOH溶液分别加到HF溶液、CH3COOH溶液中,两混合溶液中离子浓度与pH的变化关系如图所示,已知pKa=-lgKa,下列有关叙述错误的是

A. 常温下,Ka(CH3COOH)=10-5
B. a点时,c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. 常温下,0.1mo/LNaF溶液的pH小于0.1mo/LCH3COONa溶液的pH
D. 向CH3COOH溶液中加入NaOH溶液后所得的混合溶液中,
【答案】D
【解析】A.根据醋酸的电离平衡常数表达式结合图像解答;
B.a点时,![]() =0,则c(F-)=c(HF),结合溶液的pH=4和电荷守恒解答;
=0,则c(F-)=c(HF),结合溶液的pH=4和电荷守恒解答;
C.利用图像分别计算两种弱酸的电离常数,相同温度下相同浓度的钠盐中,酸的酸性越强其酸根离子水解程度越小,溶液的pH越小;
D.根据醋酸的电离平衡常数表达式计算。
A.常温下,pH=5时CH3COOH中![]() =0,则c(CH3COO-)=c(CH3COOH),Ka(CH3COOH)=c(H+)·c(CH3COO)/c(CH3COOH)=10-5,A正确;
=0,则c(CH3COO-)=c(CH3COOH),Ka(CH3COOH)=c(H+)·c(CH3COO)/c(CH3COOH)=10-5,A正确;
D.a点时,![]() =0,则c(F-)=c(HF),溶液的pH=4,则c(H+)>c(OH-),根据电荷守恒得c(F-)>c(Na+),水解程度较小,所以溶液中存在c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),B正确;
=0,则c(F-)=c(HF),溶液的pH=4,则c(H+)>c(OH-),根据电荷守恒得c(F-)>c(Na+),水解程度较小,所以溶液中存在c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-),B正确;
C.由A可知Ka(CH3COOH)=10-5,pH=4时,c(HF)=c(F-),Ka(HF)=c(H+)·c(F)/c(HF)=10-4,说明HF酸性大于醋酸,相同温度下相同浓度的钠盐中,酸的酸性越强其酸根离子水解程度越小,溶液的pH越小,则水解程度F-<CH3COO-,所以相同浓度的钠盐溶液中NaF溶液pH小于0.1molL-1的CH3COONa溶液的pH,C正确;
D.NaOH溶液加入CH3COOH溶液后的混合溶液中Ka(CH3COOH)=c(H+)·c(CH3COO)/c(CH3COOH),则c(CH3COO)/c(CH3COOH)=Ka(CH3COOH)/c(H+)=105/10pH=10pH-5,D错误;
答案选D。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
【题目】如图是周期表中短周期的一部分,A、B、C三种元素原子核外电子数之和等于B原子的质量数。B原子核内质子数和中子数相等。下列叙述不正确的是( )
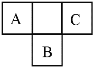
A. C元素是非金属性最强的元素
B. A元素最高价氧化物对应的水化物具有强氧化性
C. B元素的氧化物、氢化物的水溶液都呈酸性
D. 三种元素的原子半径的大小顺序是:B>C>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是
A. Al![]() NaAlO2(aq)
NaAlO2(aq) ![]() NaAlO2(s)
NaAlO2(s)
B. CuCl2![]() Cu(OH)2
Cu(OH)2![]() Cu
Cu
C. NaCl(aq)![]() NaHCO3(s)
NaHCO3(s) ![]() Na2CO3(s)
Na2CO3(s)
D. MgO(s) ![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】检验某一溶液中是否含有氯离子,可选用的试剂是( )
A.硝酸银溶液
B.稀盐酸酸化的硝酸银溶液
C.稀硝酸酸化的硝酸银溶液
D.稀硫酸酸化的硝酸银溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种天然黄铜矿主要成分为CuFeS2 (含SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验:

称取研细的黄铜矿样品1.150g煅烧,生成Cu、Fe2O3 、FeO和SO2气体,实验后取d中溶液的1/5置于锥形瓶中,用0.01mo1/L标准碘溶液进行滴定,初读数为0.10mL,末读数如图2所示.完成下列填空:
(1)装置c的作用是____________________________。
(2)上述反应结束后,仍需通一段时间的空气,其目的是_____________________。
(3)滴定时,标准碘溶液所耗体积为_____mL;用化学方程式表示滴定的原理:________________________________________。
(4)计算该黄铜矿的纯度___________________。
(5)工业上利用黄铜矿冶炼铜产生的炉渣(含Fe2O3 、FeO、SiO2、Al2O3)可制备Fe2O3.
选用提供的试剂,设计实验验证炉渣中含有FeO.
提供的试剂:稀盐酸 稀硫酸 KSCN溶液 KMnO4溶液 NaOH溶液
所选试剂为_________;证明炉渣中含有FeO的实验现象为:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓硫酸是重要的化工原料。下列关于浓硫酸的叙述中,正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸不可以用铁罐来运输
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属形成氧化膜而钝化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述不正确的是( )
A. 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为(7/22.4)NA
B. 1 mol甲基(-CH3)所含的电子总数为9NA
C. 0.5 mol1,3-丁二烯分子中含有碳碳双键数为NA
D. 1 mol碳正离子(CH3+)所含的电子总数为8NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下是实验室中测定硫酸铜晶体(CuSO4·xH2O)结晶水含量的实验流程。

回答下列问题
(1)写出操作名称:操作Ⅱ____________操作Ⅲ____________
(2)重复操作Ⅰ、Ⅱ、Ⅲ,这叫_________操作。目的是_________________
(3)实验数据如下表:

试计算:两次实验的平均值 x=_______(保留到小数点后 2 位) 本次实验误差=______(相对误差)
(4)造成本次实验误差可能的原因是_______。
A、加热时间过长,晶体略有发黑现象
B、固体冷却时未放在干燥器中
C、硫酸铜晶体中混有受热不分解的杂质
D、加热过程中,有晶体溅出
E、取用的样品中已混入前面同学操作后的无水硫酸铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com