
����Ŀ���м�����λͬѧ��������ԭ��ط�Ӧ�������Ļ��˳�����˾�ʹ��þƬ����Ƭ���缫������ͬѧ���缫���� 6mol/L ��������Һ����ͬѧ���缫���� 6mol/L ������������Һ�У���ͼ��ʾ��
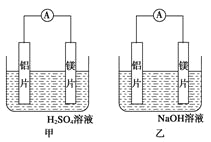
��1��д������������ĵ缫��Ӧʽ___________________ ��
��2��д���ҳ��и����ĵ缫��Ӧʽ�� ������_____ �ܷ�Ӧ�����ӷ���ʽ��_________
��3�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ� �����ɸ������ϵĽ�������
������жϳ�_____��Ը�ǿ�����һ��жϳ�_____��Ը�ǿ�������ƣ�
��4���ɴ�ʵ�飬�ɵõ�������Щ��ȷ������_____��
a. ����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ���
b. þ�Ľ����Բ�һ��������ǿ
c. ��ʵ��˵���������˳����ѹ�ʱ����û�����ü�ֵ
d. ��ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ��������������
��5������ʵ��Ҳ������֤������ֱ�����ý������˳����ж�ԭ����е�����������������__�� ���ɿ����������ɿ��������粻�ɿ������������һ���ж�ԭ����������Ŀ���ʵ�鷽��_______________ ���� �ɿ����ɲ��
���𰸡�2H+��2e��= H2�� Al��3e����4OH��= AlO2����2H2O 2Al ��2OH����2H2O = 2AlO2����3H2�� þ �� ad ���ɿ� ͨ�����������ж�
��������
�ż���и���ΪþƬ������Ϊ��Ƭ�������ĵ缫��Ӧʽ��Mg��2e�� = Mg2���������ĵ缫��Ӧʽ��2H+��2e��= H2�����ʴ�Ϊ2H+��2e��==H2����
��д���ҳ��и����ĵ缫��Ӧʽ�������缫��Ӧʽ��Al��3e����4OH��= AlO2����2H2O�������ĵ缫��Ӧʽ��2H+��2e��= H2�����ܷ�Ӧ�����ӷ���ʽ��2Al ��2OH����2H2O =
2AlO2����3H2�����ʴ�ΪAl��3e����4OH��= AlO2����2H2O��2Al ��2OH����2H2O = 2AlO2����3H2����
�����������ͬѧ����Ϊ������ԭ��صĵ缫����������ǽ������ɸ������ϵĽ�������
������жϳ�þƬ��Ը�ǿ�����һ��жϳ���Ƭ��Ը�ǿ���ʴ�ΪþƬ����Ƭ��
��aѡ�����ԭ��ط�Ӧ�жϽ������˳��ʱӦע��ѡ����ʵĽ��ʣ�ԭ�����������������Һ�йأ�����ȷ��
bѡ�þ�Ľ�����һ������ǿ����b����
cѡ���ʵ��˵���������˳�����δ��ʱ����c����
dѡ���ʵ��˵����ѧ�о������ӣ���Ӧ������Ӱ��ϴ����Ӧ������������������d��ȷ��
������������Ϊad��
������ʵ��Ҳ������֤������ֱ�����ý������˳����ж�ԭ����е��������������������ɿ����ʴ�Ϊ���ɿ������ǿ��Ը���ԭ����е������ƶ��������ж�ԭ��ص����������ʴ�Ϊͨ�����������жϣ�


 ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���п�Ժ������ѧ�����о�����һ�����³ɹ�ʵ���˼����Ч������ϩ�������ڴ����������⣬�������о����ɻ�ż����Ӧ������ϩ����ͼ��ʾ��

��1���ִ�ʯ�ͻ�������Ag����������ʵ����ϩ�������Ʊ�X������ʽC2H4O������˫�������÷�Ӧ�����������ԭ�Ӿ��ã���Ӧ�Ļ�ѧ����ʽ��______________���л�����д�ṹ��ʽ����
��2����֪������ʵ�ȼ�������ϱ���д�������Ʊ���ϩ���Ȼ�ѧ����ʽ_____________��
��3����400 ��ʱ�����ʼ���1 L�ĺ�ѹ��Ӧ���г���1 molCH4������������Ӧ�����ƽ����������C2H4���������Ϊ20.0%����
���ڸ��¶��£���ƽ�ⳣ��K��________��
�����������ͨ�����ˮ���������μӷ�Ӧ������400�棩��C2H4�IJ��ʽ�________��ѡ��������������С��������������ȷ��������������_____________��
������������̶�����ͬѹǿ�¿ɵñ仯����ͼ����ѹǿ�Ĺ�ϵ��__________��

��ʵ���Ʊ�C2H4ʱ��ͨ�����ڸ���Ӧ��2CH4(g) ��C2H6(g)��H2(g)����Ӧ����CH4��ʼ�����䣬��ͬ�¶���C2H6��C2H4������������¶ȵĹ�ϵ������ͼ��

A����200 ��ʱ����������������ϩ�����Ҫԭ�������_____________��
B��400��ʱ��C2H4��C2H6����������ֱ�Ϊ20.0%��6.0%������ϵ��CH4�����������_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֿ���������A��B��C��������һ���Ǽ�������Σ�����ˮ�����������������±���ʾ��
������ | Na�� H�� Ba2�� |
������ | OH�� CO32�� SO42�� |
Ϊ�������ǣ��ֱ����һЩʵ�顣�����ʵ��Ľ���ش��������⣺
��1��A��Һ��B��Һ��Ӧ����������X������������������֮��Ŀ��ܷ�Ӧ�ж�X�Ļ�ѧʽΪ ��A��Һ��B��Һ��Ӧ�����ӷ���ʽΪ ��
��2������X���Ժ�C��Һ��Ӧ���ɳ���D������D����B��Һ��Ӧ����C�Ļ�ѧʽΪ ��B����ˮ��ĵ��뷽��ʽΪ ��
��3��B��Һ��C��Һ��Ӧ���ɲ�����ϡ����İ�ɫ����E��B��Һ��C��Һ��Ӧ�����Ե����ӷ���ʽΪ ��
��4��D��E�Ļ����ag�������������ᣬ��ȫ��Ӧ���ɵ������ڱ�״�������ΪbL��������E�ڻ�����е����������ı���ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25������20 mL 0.1 mol��L1 MOH��Һ�еμ�0.1 mol��L1 CH3COOH��Һ, ������Һ��pH(��Ӧ����M)����������(��Ӧ����N)�仯��ͼ��ʾ������������ȷ����
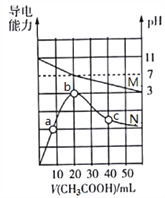
A. MOH�������Kb��1.0��1021
B. b����Һ�У�c(CH3COO)�� c(CH3COOH)��0.1 mol��L1
C. ˮ�����ӻ�����Kw��b��c��a
D. c����Һ�У�c(CH3COO)��c(M+)��c(H+)��c(OH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������VmL 2.0mol��L��1������������Һ����Ҫ�������ƹ�������______ g�� ���в���,��ʹ�������ҺŨ����α仯��
��1����ȡ�������ƹ���ʱ�����������ƽ���̵�ֽƬ��:______ ��
��2������ʱ���������ʹ��������:_______��
��3������ƿ������ˮϴ����û�к��:________��
��4��û�еȵ���Һ��ȴ�����¾ͽ���Һע������ƿ��:______��
��5��ת����Һʱ����Һ����:_____,
��6��û��������ˮϴ�ձ��Ͳ�����:____,
��7������ʱ����Һ��:_____,
��8������ʱ����Һ��:____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 100 g FeCl3 �� CuCl2 �Ļ����Һ�м������ۡ���֪ FeCl3���������۷�����Ӧ��2FeCl3 + Fe =3FeCl2����ͼΪ�������۵������뷴Ӧ��ʣ�����������ϵ������˵������ȷ����

A.D ���Ӧ������Ϊ 6.4
B.B �����Һ����ɫΪ��ɫ
C.�� 100 g ��Һ�е� CuCl2��������Ϊ 13.5%
D.ȡ DE ����䣨���� D����ʣ�����������ᣬ�������ݲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ���������ֵ������˵����ȷ����
A. 2.1g��ϩ�������Ĺ��õ��Ӷ�����Ϊ0.3NA
B. 4.6gNO2��N2O4�Ļ�������к��еĵ�ԭ����Ϊ0.1NA
C. ��������ֽ��Ƶñ�״����2.24LO2��ת�Ƶ�����ĿΪ0.4NA
D. �ڸ��¸�ѹ�������������£�56gN2��12gH2��ַ�Ӧ������NH3�ķ�����Ϊ4NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ� Fe(OH)2��װ������ͼ��ʾ�����е����������Ϸֱ�Ϊ����ʯī��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ������������˵����ȷ����
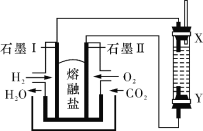
A. ʯī�缫�����ĵ缫��ӦʽΪO2+4e-=2O2-
B. X�����缫
C. ��������1mol Fe�ܽ⣬ʯī����H2 22.4 L
D. �������������ͨ���廥����X��Y��������Ҳ����, ʵ�鷽����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ɫ��ѧʵ���������ã�ij��ѧ��ʦΪ������������Ʒ�Ӧ���������ͼ��ʾװ��������������صĿα�ʵ��������ȸ���Ԥ�ȣ��������ڳ�Բ��ʱ������ͨ�����������ɼ����Ż�ȼ�գ��������������̡����������������(����)
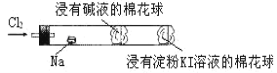
A.���Ż�ȼ�ղ�����ɫ���棬�����ɴ�������
B.���в���һ�Ž���NaOH��Һ���������������չ�������������������Ⱦ����
C.���Ҷ˽��е���KI��Һ��������ɫ�仯���ж������Ƿ�Һ��ȫ����
D.ʵ���������Ԫ��ԭ�Ӳ������DZ���ԭ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com