
【题目】(1)已知:Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g)ΔH=+19 kJ·mol-1 ③
请写出CO还原FeO的热化学方程式:_______________________。
(2)某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T1 ℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
①T ℃时,该反应的平衡常数K=________。
②30 min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A
c.适当缩小容器的体积 d.升高反应体系温度
③若该密闭容器绝热,实验测得B的转化率随温度变化的示意图如图所示。由图可知,Q________0(填“大于”或“小于”),c点v正________v逆(填“大于”、“小于”或“等于”)。

【答案】CO(g)+FeO(s)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1 0.25 a 小于 等于
【解析】
(1)首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式,以此计算△H;
(2)①由表可知T1 ℃时,20分钟反应达平衡状态,结合平衡浓度和平衡常数概念计算,所以K=![]() ;
;
②30nim后,BDE都增加,由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物;
③最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应。
(1)由已知热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H1=-25kJ/mol,②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H2=-47kJ/mol,③Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H3=19kJ/mol,根据盖斯定律可得(3×①-②-2×③)÷6得CO还原FeO的热化学方程式Fe(s)+CO(g)═Fe(s)+CO2(g),△H=(3×△H1-△H2-2×△H3)÷6=-11kJ/mol,故答案为:Fe(s)+CO(g)═Fe(s)+CO2(g)△H=-11kJ/mol;
(2)①由表可知T1 ℃时,20分钟反应达平衡状态,结合平衡浓度和平衡常数概念计算,所以K=![]() =
=![]() =0.25,故答案为:0.25;
=0.25,故答案为:0.25;
②30nim后,BDE都增加,由图可知反应体系反应物和生成物的物质的量都增加,可能增大反应物B的量,平衡正向移动,导致反应物和生成的物质的量都增加,或按变化量同时改变反应物和生成物。a.通入一定量的B平衡正向进行,BDE增大,故a符合;b.加入一定量的固体A不影响平衡移动,BDE不变,故b不符合;c.反应前后气体体积不变,适当缩小容器的体积,平衡不移动,故c不符合;d.反应是吸热反应,升高反应体系温度,平衡正向进行,B减小,故d不符合,故答案为a;
③最高点达平衡状态,温度升高B的转化率减小,所以正反应是放热反应,即Q小于0,c点为平衡状态,正逆反应速率相等,故答案为:小于;等于


科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号),判断理由为________________________。
(2)铜晶体中铜原子的堆积方式如图24所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图25所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是_______________________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______________________。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为______pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子化合物H的合成路线如下:

已知:i. 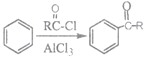
ii. 
回答下列问题
(1)A的化学名称为___________。
(2)B→C的化学方程式为______________________。
(3)E的结构简式为___________;由E生成F的反应类型为______________________。
(4)G中官能团名称为___________;由G→H的化学方程式为______________________。
(5)芳香族化合物L与G的官能团相同,但L的相对分子质量比G小28。则符合下列条件的L的同分异构体有___________种。
①与FeCl3溶液发生显色反应 ②苯环上有3个取代基
(6)按 有机合成路线可以制备
有机合成路线可以制备 。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
。结合题中流程和已知信息,可推知M、N的结构简式分别为___________、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电池接通后,向乙中滴入酚酞溶液,在F极附近溶液显红色。则以下说法正确的是

A.电源B极是正极
B.甲、乙装置的C、D、E、F电极均有单质生成,其物质的量之比为1∶2∶2∶1
C.欲用丙装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
D.装置丁中Y极附近红褐色变深,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资源化利用CO2,不仅可以减少温室气体的排放,还可以获得燃料或重要的化工产品。
(1)CO2的捕集:
①写出CO2的电子式__________。
②用饱和Na2CO3溶液做吸收剂可“捕集”CO2。若吸收剂失效,可利用NaOH溶液使其再生,写出该反应的离子方程式___________。
③聚合离子液体是目前广泛研究的CO2 吸附剂。结合下图分析聚合离子液体吸附CO2的有利条件是__________。

(2)生产尿素:
工业上以CO2、NH3为原料生产尿素[CO(NH2)2],该反应分为二步进行:
第一步:2NH3(g)+CO2(g)![]() H2NCOONH4(s) △H =-159.5 kJ/mol
H2NCOONH4(s) △H =-159.5 kJ/mol
第二步:H2NCOONH4(s)![]() CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
CO(NH2)2(s)+ H2O(g) △H =+116.5 kJ/mol
①写出上述合成尿素的热化学方程式_________。
②某实验小组模拟工业上合成尿素,在一定体积的密闭容器中投入4mol NH3和1mol CO2,实验测得反应中各组分物质的量随时间的变化如图所示:

已知总反应的快慢由慢的一步反应决定,则合成尿素总反应的快慢由第______步反应决定,总反应进行到________min时到达平衡。
(3)合成乙酸:
①中国科学家首次以CH3OH、CO2和H2为原料高效合成乙酸,其反应路径如图所示:

原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___。
②根据图示,写出总反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(CH3OCH3)。下列说法不正确的是
①C(s) + H2O(g)==CO(g)+H2(g) ΔH1=a kJmol-1
②CO(g) + H2O(g)==CO2(g)+H2(g) ΔH2=b kJmol-1
③CO2(g)+3H2(g)==CH3OH(g)+H2O(g) ΔH3 =c kJmol-1
④2CH3OH(g) ==CH3OCH3(g)+H2O(g) ΔH4=d kJmol-1
A. 反应①②为反应③提供原料气
B. 反应③也是CO2资源化利用的方法之一
C. 反应CH3OH(g)== ![]() CH3OCH3(g)+
CH3OCH3(g)+ ![]() H2O(1)的ΔH =
H2O(1)的ΔH =![]() kJmol-1
kJmol-1
D. 反应 2CO(g)+4H2(g) ==CH3OCH3(g)+H2O(g)的ΔH= (2b+2c+d) kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗铜精炼后的阳极泥含有Cu、Ag和Au(金)等。湿法处理阳极泥的一种工艺流程如下:

(1)在粗铜精炼过程中,粗铜与电源的__________极(填正、负)连接;阴极的电极反应式为______________________________________________________。
(2)在浸铜过程中,浸铜反应的离子方程式为_______________________________________________________,
生产中实际需要H2O2的量要远远超过浸铜所需的理论用量,可能的原因是________________________________________________。
(3)已知:浸金时,Au转化为AuCl4-。在理论上,提取金的过程中反应消耗NaClO3和H2C2O4的物质的量之比为__________。
(4)已知: 浸银时发生反应AgCl+2SO32-![]() Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
Ag(SO3)23-+Cl-;Ag(SO3)23-将HCHO氧化为CO32-。
①为减少废液排放,充分利用资源,向浸银残液中通入气体X得到Na2SO3再生液,X是__________。
②在提取银过程中,其他条件不变,Na2SO3再生液的循环使用次数与银的浸出率关系如图所示。

试结合平衡移动原理,解释产生这种变化的原因_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设![]() 为阿伏加德罗常数的值。下列说法错误的是
为阿伏加德罗常数的值。下列说法错误的是
A. 0.1mol![]() 和0.1mol
和0.1mol![]() 于密闭容器中充分反应,反应后分子总数为0.2
于密闭容器中充分反应,反应后分子总数为0.2![]()
B. 向过氧化钠中通入足量的二氧化碳,当固体增重28g,转移电子数为l![]()
C. 在标准状况下,22.4LHF与![]() 个
个![]() 中含有的电子数相同
中含有的电子数相同
D. 含有![]() 个
个![]() 胶粒的氢氧化铁胶体中,铁元素的质量大于56g
胶粒的氢氧化铁胶体中,铁元素的质量大于56g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com