


科目:高中化学 来源: 题型:
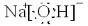
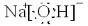
查看答案和解析>>
科目:高中化学 来源:素质教育新教案 高中化学·二年级·第二册(上册) 题型:022
完成并配平化学方程式(在空格内填入系数或化合物的分子式)
![]() KMnO4+
KMnO4+![]() KNO2+
KNO2+![]()
![]()
![]()
![]() MnSO4+
MnSO4+![]() K2SO4+
K2SO4+![]() KNO3+
KNO3+![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014学年北京市东城区高三上学期期末统一练习化学试卷(解析版) 题型:填空题
溴及其化合物广泛应用在有机合成、化学分析等领域。
(1)海水提溴过程中溴元素的变化如下:

①过程Ⅰ,海水显碱性,调其pH<3.5后,再通入氯气。
ⅰ.通入氯气后,反应的离子方程式是______。
ⅱ.调海水pH可提高Cl2的利用率,用平衡原理解释其原因是______。
②过程Ⅱ,用热空气将溴赶出,再用浓碳酸钠溶液吸收。完成并配平下列方程式。
Br2+ Na2CO3 =
Na2CO3 = NaBrO3+
NaBrO3+ CO2+
CO2+ ______
______
③过程Ⅲ,用硫酸酸化可得Br2和Na2SO4的混合溶液。
相同条件下,若用盐酸酸化,则所得溴的质量减少,原因是______。
(2)NaBrO3是一种分析试剂。向硫酸酸化的NaI溶液中逐滴加入NaBrO3溶液,当加入2.6 mol NaBrO3时,测得反应后溶液中溴和碘的存在形式及物质的量分别为:
|
粒子 |
I2 |
Br2 |
IO3- |
|
物质的量/mol |
0.5 |
1.3 |
|
则原溶液中NaI的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com