
【题目】常温下,几种酸的电离平衡常数如下:

回答下列问题:
(1)物质的量浓度均为0.1mol·L-1的①NaClO溶液 ②Na2CO3溶液 ③NaHCO3溶液 ④Na2SO3溶液,pH值由大到小的顺序是____________________。(填序号)
(2)用离子方程式表示NaClO溶液呈碱性的原因是____________________________________________。
(3)0.1mol/L的氯化铵溶液中各离子物质的量浓度由大到小的顺序是___________,只改变下列一个条件,能使c(NH4+)与c(Cl-)比值变大的是______________________。(填标号)
A.加入固体硫酸铵
B.通入少量氯化氢
C.降低溶液温度
D.加入少量固体氢氧化钠
(4)假设25 ℃时,0.1mol/L氯化铵溶液由水电离出的氢离子浓度为1×10-6mol/L,则在该温度下此溶液中氨水的电离平衡常数:Kb(NH3·H2O)=_________________________________。
【答案】②①④③ ClO-+H2O![]() HClO+OH- c(Cl-)>c(NH4+)>c(H+)>c(OH-) AC 10-3
HClO+OH- c(Cl-)>c(NH4+)>c(H+)>c(OH-) AC 10-3
【解析】
(1)所给物质属于强碱弱酸盐,溶液显碱性,根据题中酸的电离平衡常数,得出电离出H+能力大小顺序是H2SO3>H2CO3>HSO3->HClO>HCO3-,利用越弱越水解的规律,得出水解程度大小顺序是CO32->ClO->SO32->HCO3-,因此pH大小顺序是②>①>④>③;
(2)NaClO属于强碱弱酸盐,ClO-发生水解:ClO-+H2O![]() HClO+OH-,使c(OH-)>c(H+),溶液显碱性;
HClO+OH-,使c(OH-)>c(H+),溶液显碱性;
(3)NH4Cl为强酸弱碱盐,NH4+发生水解:NH4++H2O![]() NH3·H2O+H+,溶液显酸性,因为NH4+水解程度微弱,因此离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);A、硫酸铵化学式为(NH4)2SO4,氯化铵溶液加入硫酸铵,c(NH4+)增大,即c(NH4+)/c(Cl-)增大,故A符合题意;
NH3·H2O+H+,溶液显酸性,因为NH4+水解程度微弱,因此离子浓度大小顺序是c(Cl-)>c(NH4+)>c(H+)>c(OH-);A、硫酸铵化学式为(NH4)2SO4,氯化铵溶液加入硫酸铵,c(NH4+)增大,即c(NH4+)/c(Cl-)增大,故A符合题意;
B、加入HCl,抑制NH4+的水解,c(NH4+)增大,HCl为强电解质,完全电离出H+和Cl-,c(Cl-)增加的比c(NH4+)增加多,即c(NH4+)/c(Cl-)减少,故B不符合题意;
C、盐类水解为吸热反应,降低温度,抑制NH4+水解,c(CNH4+)增大,c(Cl-)不变,即c(NH4+)/c(Cl-)增大,故C符合题意;
D、加入少量NaOH,发生NH4++OH-=NH3·H2O,c(NH4+)减小,c(Cl-)不变,即c(NH4+)/c(Cl-)减小,故D不符合题意;
(4)NH4+发生水解:NH4++H2O![]() NH3·H2O+H+,c(NH3·H2O)=c(H+)=10-6mol·L-1,c(NH4+)=(0.1-10-6)mol·L-1≈0.1mol·L-1,c(OH-)=Kw/c(H+)=10-14/10-6mol·L-1=10-8mol·L-1,NH3·H2O电离方程式为NH3·H2O
NH3·H2O+H+,c(NH3·H2O)=c(H+)=10-6mol·L-1,c(NH4+)=(0.1-10-6)mol·L-1≈0.1mol·L-1,c(OH-)=Kw/c(H+)=10-14/10-6mol·L-1=10-8mol·L-1,NH3·H2O电离方程式为NH3·H2O![]() NH4++OH-,Kb=c(NH4+)×c(OH-)/c(NH3·H2O),代入数值,Kb=10-3。
NH4++OH-,Kb=c(NH4+)×c(OH-)/c(NH3·H2O),代入数值,Kb=10-3。


科目:高中化学 来源: 题型:
【题目】常温下①、②两个装有50mL氯气的针筒,分别抽取10mLH2O和10mL15%的NaOH溶液(如图所示),充分振荡后静置,对两针筒中所得溶液描述错误的是

A | B | C | D | |
针筒① | 有颜色 | 有漂白性 | 呈酸性 | 含Cl2分子 |
针筒② | 无颜色 | 无漂白性 | 呈碱性 | 无Cl2分子 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.下列各组物质性质的比较,结论正确的是(____________)
A. 分子的极性:![]() B. 物质的硬度:
B. 物质的硬度:![]()
C. 物质的沸点:![]() D.在
D.在![]() 中的溶解度:
中的溶解度:![]()
Ⅱ.锰单质及其化合物应用十分广泛。回答下列问题:

(1)![]() 位于元素周期表中第四周期____族,基态
位于元素周期表中第四周期____族,基态![]() 原子核外未成对电子有_____个。
原子核外未成对电子有_____个。
(2)![]() 可与
可与![]() 反应生成
反应生成![]() ,新生成的化学键为_____键。
,新生成的化学键为_____键。![]() 分子的空间构型为______,其中N原子的杂化轨道类型为_______。
分子的空间构型为______,其中N原子的杂化轨道类型为_______。
(3)金属锰有多种晶型,其中![]() 的结构为体心立方堆积,晶胞参数为apm,
的结构为体心立方堆积,晶胞参数为apm, ![]() 中锰的原子半径为_____pm。已知阿伏加德罗常数的值为
中锰的原子半径为_____pm。已知阿伏加德罗常数的值为![]() ,
, ![]() 的理论密度
的理论密度![]() ____
____![]() 。(列出计算式)
。(列出计算式)
(4)已知锰的某种氧化物的晶胞如图所示,其中锰离子的化合价为____,其配位数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,请回答下列问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 | |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)在这些元素中,单质的化学性质最不活泼的是___(填元素符号)。
(2)③的气态氢化物的电子式___,②④形成的气态化合物的结构式___。
(3)这些元素形成的最高价氧化物的水化物中,碱性最强的化合物为___(填物质的化学式),写出它的电子式:___;酸性最强的含氧酸为___(填物质的化学式),写出它的电离方程式:___。
(4)在②和③两种元素中,非金属性较强的是___(填元素名称),②的单质可以和③的最高价氧化物的水化物反应,请写出有关化学方程式___。
(5)②与Si元素分别形成的最高价氧化物,___的熔点更高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年为门捷列夫发现元素周期律150周年。门捷列夫预言了很多未知元素,锗是其中一种,工业上用精硫锗矿(主要成分为GeS2)制取高纯度锗,其工艺流程如图所示。请回答:
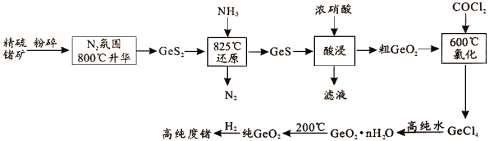
(1)锗在元素周期表中的位置是__________。
(2)800℃,在N2氛围中使精硫锗矿升华的目的是______________。
(3)酸浸时Ge、S元素均被氧化到最高价态,写出该反应的离子方程式____。酸浸时温度不能过高的原因是_____
(4)GeCl4易水解生成GeO2·nH2O,此过程化学方程式为_____。温度对GeCl4水解率的影响如图所示,为提高水解率,实验时可采取的措施为______(填序号)。

A.冰水浴
B.冰盐水浴
C.49℃水浴
(5)请判断25℃时0.1mol·L-1NaHGeO3溶液pH________(填“>”=”或“<”)7,理由是____(已知25℃时,H2GeO3的Ka1=1.7×10-9,Ka2=1.9×10-13)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列条件不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g)已达到平衡状态的是
C(g)+D(g)已达到平衡状态的是
A. 混合气体的压强 B. 气体的总物质的量
C. 混合气体的密度 D. 单位时间内生成n molC的同时消耗2n molB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶性物质K2SO4·MgSO4·2CaSO4在水中存在如下平衡: K2SO4·MgSO4·2CaSO4(s)![]() 2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是
2Ca2+(aq)+2K+(aq)+Mg2+(aq)+4SO42- (aq),不同温度下,K+的浸出浓度与溶浸时间的关系如图所示。则下列说法错误的是

A. 向该体系中分别加入饱和NaOH溶液和饱和碳酸钠溶液,沉淀溶解平衡均向右移动
B. 分析可知T1>T2>T3
C. 升高温度,溶浸速率增大,平衡向右移动
D. 该物质的Ksp=c2(Ca2+)·c2(K+)·c(Mg2+)·c4(SO42-)/c(K2SO4·MgSO4·2CaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是( )
A.NH4Cl![]() NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
NH3↑+HCl↑B.2Na2O2+2CO2=2Na2CO3+O2
C.2NaOH+Cl2=NaCl+NaClO+H2OD.NH3+CO2+H2O=NH4HCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com