【答案】
分析:(1)①根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
②根据氧化还原反应规律,CO与PdCl
2溶液反应,PdCl
2被还原成单质,则CO被氧化成CO
2,根据质量守恒定律,有水参与反应同时生成氯化氢,据此写出反应的化学方程式即可;
(2)①根据C
3H
8和O
2构成丙烷燃料电池的总反应:C
3H
8+5O
2+6OH
-=3CO
32-+7H
2O,正极发生还原反应,电极反应式为:O
2+4e
-+2H
2O=4OH
-,而负极电极反应式=总反应方程式-正极的电极反应式来解答;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
C、阳极应该用铁电极,阴极用惰性电极亦可;
D、B电极反应是阴极氢离子放电生成氢气;
(3)①比较第二组的第一组反应物的转化率大小以及温度对化学平衡和转化率的影响来判断;
②首先利用三段式计算出平衡时各物质的浓度,根据K=
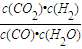
计算;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO
2,与0.3molNaOH反应的化学方程式为:2CO
2+3NaOH=NaHCO
3+Na
2CO
3+H
2O,生成0.1molNa
2CO
3、0.1molNaHCO
3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,碳酸根离子水解大于碳酸氢根离子的水解,水解使溶液显碱性,以此来解答.
解答:解:(1)①Fe
2O
3(s)+3C(石墨)=2Fe(s)+3CO(g)△H
1=+489.0kJ/mol ①
C(石墨)+CO
2(g)=2CO(g)△H
2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe
2O
3(s)+3CO(g)=2Fe(s)+3CO
2(g)△H=-28.5kJ/mol,
故答案为:Fe
2O
3(s)+3CO(g)=2Fe(s)+3CO
2(g)△H=-28.5kJ/mol,
②氧化还原反应规律,CO与PdCl
2溶液反应,PdCl
2被还原成单质,则CO被氧化成CO
2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl
2+CO+H
2O=Pd+CO
2+2HCl,故答案为:PdCl
2+CO+H
2O=Pd+CO
2+2HCl;
(2)C
3H
8和O
2构成丙烷燃料电池的总反应:C
3H
8+5O
2+6OH
-=3CO
32-+7H
2O,正极发生还原反应,电极反应式为:O
2+4e
-+2H
2O=4OH
-,负极发生氧化反应,电极反应式为:C
3H
8 +26OH
--20e
-=3CO
32-+17H
2O;故答案为:C
3H
8 +26OH
--20e
-=3CO
32-+17H
2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阴极氢离子放电,其电极反应为2H
++2e
-=H
2↑,故D正确;
故选:ABD;
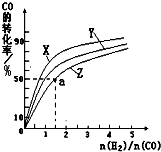
(3)①实验1中CO的转化率为
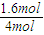
×100%=40%,实验2中CO的转化率为
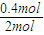
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故答案为:放热;
②H
2O(g)+CO(g)

CO
2(g)+H
2(g)
初始 1mol/L 2mol/L 0 0
转化 0.4mol/L 0.4mol/l 0.4mol/l 0.4mol/l
平衡 0.6mol/L 1.6mol/L 0.4mol/l 0.4mol/l
根据K=
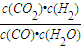
=
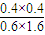
=

,故答案为:

;
③实验3跟实验2相比,温度相同,浓度相同,但实验3达到平衡所用时间少,反应速率更大,但平衡状态没有发生移动,应是使用了催化剂,又由于反应前后气体体积不变,则增大了压强,平衡也不移动,也可能为压强的增大,故答案为:使用了催化剂或增大了压强;
(4)2.4g碳是0.2mol,燃烧生成0.2molCO
2,与0.3molNaOH反应的化学方程式为:2CO
2+3NaOH=NaHCO
3+Na
2CO
3+H
2O,生成0.1molNa
2CO
3、0.1molNaHCO
3,在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na
+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO
3-)>c(CO
32-),水解使溶液显碱性,则c(OH
-)>c(H
+),显性离子大于隐性离子,所以c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+),即离子浓度大小为:c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+),故答案为:c(Na
+)>c(HCO
3-)>c(CO
32-)>c(OH
-)>c(H
+).
点评:本题考查热化学方程式、电极反应的书写以及化学平衡的计算、离子浓度大小比较,做题时注意把握影响平衡移动的因素以及平衡常数的有关计算,比较离子浓度大小时应掌握溶液的成分,题目难度中等.


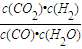 计算;
计算;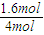 ×100%=40%,实验2中CO的转化率为
×100%=40%,实验2中CO的转化率为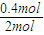 ×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故答案为:放热;
×100%=20%,则实验1的转化率大于实验2,则说明温度升高平衡向逆反应方向移动,正反应放热,故答案为:放热; CO2(g)+H2(g)
CO2(g)+H2(g)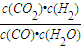 =
=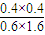 =
= ,故答案为:
,故答案为: ;
;

 (2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
(2013?通州区二模)碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.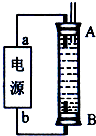 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新的生活方式.