
下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白(填写序号不得分):
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | | | | ① | ② | ③ | | |
| 3 | ④ | | | ⑤ | | ⑥ | ⑦ | ⑧ |
| 4 | ⑨ | | | | | | ⑩ | |
(1)Ar;
(2)HClO4 KOH;
(3)H2CO3 Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓
(4)2NH3Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O NH4NO3;
CaCl2+2NH3↑+2H2O NH4NO3;
(5)3NO2+H2O=2HNO3+NO
(6)H2O
(7)2Na+2H2O=2Na++2OH-+H2↑
(8) ,<,第四周期ⅦA族
,<,第四周期ⅦA族
解析试题分析:这几种元素分别是:①C;②N ;③O;④Na;⑤Si;⑥S ;⑦Cl ; ⑧Ar; ⑨K; ⑩Br。同一周期的元素,随着原子序数的增大,元素的金属性逐渐减弱,非金属性逐渐增强,最后以最不活泼的惰性气体元素结束。在同一主族的元素,从上到下,元素的原子半径逐渐增大,元素的金属性逐渐增强,非金属性逐渐减弱。(1)在这些元素中,化学性质最不活泼的是⑧Ar元素; (2)在最高价氧化物的水化物中,酸性最强的化合物的HClO4。碱性最强的化合物KOH。(3)C、Si是同一主族的元素,非金属性C>Si。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。因此比较①与⑤的最高价氧化物对应的水化物的酸性强的是H2CO3。可以通过反应CO2+H2O + Na2SiO3= H2SiO3↓+ Na2CO3证明。(4)在实验室一般是用铵盐与碱共热来制取氨气的。制取NH3的方程式为2NH3Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。②的氢化物NH3与②的最高价氧化物的水化物HNO3反应:NH3+ HNO3= NH4NO3.因此反应产物是NH4NO3。(5)NO2是红棕色气体,它能溶解于水,发生反应3NO2+H2O=2HNO3+NO。(6)③O与⑥S是同一主族的元素,由于非金属性O>S。元素的非金属性越强,其对应的氢化物的稳定性就越强。元素稳定性H2O >H2S。(7)Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑。(8)Cl-离子结构示意图为:
CaCl2+2NH3↑+2H2O。②的氢化物NH3与②的最高价氧化物的水化物HNO3反应:NH3+ HNO3= NH4NO3.因此反应产物是NH4NO3。(5)NO2是红棕色气体,它能溶解于水,发生反应3NO2+H2O=2HNO3+NO。(6)③O与⑥S是同一主族的元素,由于非金属性O>S。元素的非金属性越强,其对应的氢化物的稳定性就越强。元素稳定性H2O >H2S。(7)Na与水反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑。(8)Cl-离子结构示意图为: .Cl-、S2-核外电子排布都是2、8、8.电子层结构相同。对于电子层结构相同的微粒来说,离子的核电荷数也多,离子半径就越小。因此离子半径Cl-<S2-。⑩元素Br在周期表的位置是位于第四周期第ⅦA族。
.Cl-、S2-核外电子排布都是2、8、8.电子层结构相同。对于电子层结构相同的微粒来说,离子的核电荷数也多,离子半径就越小。因此离子半径Cl-<S2-。⑩元素Br在周期表的位置是位于第四周期第ⅦA族。
考点:考查元素的推断、元素的原子或离子半径的比较、元素形成的氢化物、酸是酸性强弱的比较、气体实验室制法、离子方程式的书写的知识。


科目:高中化学 来源: 题型:填空题
【化学-选修3物质结构与性质】(15分)
请回答以下问题:
(1)第四周期的某主族元素,其第一至五电离能数据如下图1所示,则该元素对应原子的M层电子排布式为 .
(2)如下图2所示,每条折线表示周期表ⅣA-ⅦA中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是 .简述你的判断依据 .
(3)CO2在高温高压下所形成的晶体其晶胞如下图3所示.该晶体的类型属于 (选填“分子”“原子”“离子”或“金属”)晶体,该晶体中碳原子轨道的杂化类型为 。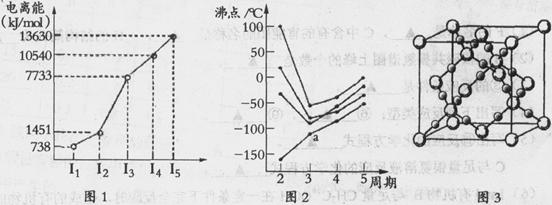
(4)在离子晶体中正、负离子间力求尽可能多的接触,以降低体系的能量,使晶体稳定存在。已知Na+半径是Cl-的a倍,Cs+半径是Cl-的b倍,请回顾课本上NaCl和CsCl的晶胞,其晶胞边长比为 .
(5)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A-D图中正确的是 .铁原子的配位数是 ,假设铁原子的半径是r cm,该晶体的密度是p g/cm3,则铁的相对原子质量为 (设阿伏加德罗常数的值为NA)。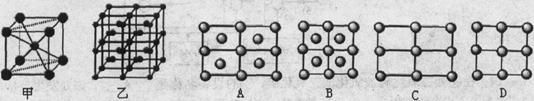 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)X、Y、Z、W是常见的四种短周期元素,其原子序数依次增大。其相关信息如下表:
| 元素 | 相关信息 |
| X | X的基态原子最外层电子排布式为nsnnpn |
| Y | Y是空气中含量最高的元素 |
| Z | Z是地壳中含量最高的金属元素 |
| W | W的单质是常见的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C、D代表元素周期表中4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素氢化物比同族元素氢化物熔沸点高的原因是 ;第一电离能比后面一号元素大的原因是
(2)B元素与氧元素形成的一种化合物是含有4个原子18个电子的分子,该化合物的电子式为 ,若向该化合物的稀溶液中加入少量二氧化锰,有无色气体产生,该反应的化学方程式为
(3)C元素的正三价离子的 3d轨道为半充满状态,C元素的符号为 ,在同期表中位于 周期 族,原子结构示意图为
(4)D元素位于元素周期表第四周期第ⅠB族,其基态原子的电子排布式为
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(12分)【化学——物质结构与性质】短周期元素A、B、C、D,A元素的原子最外层电子排布式为ms1,B元素的原子价电子排布式为ns2 np2,C元素位于第二周期且原子中p亚层与所有s亚层电子总数相等,D元素原子的L层的p亚层中有3个未成对电子。
(1)C元素原子基态时的价电子排布式 ,若A元素为非金属元素.A与C形成的化合物中的共价键属于 键(填“ ”或“
”或“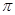 ”)。
”)。
(2)当n=2时.B的最简单气态氢化物的分子构型为 ,中心原子的杂化方式为 ,BC2属于 分子(填“极性”或“非极性”),当n=3时,B与C形成的晶体属于____ 晶体;
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,A、B、C、D四种元素的第一电离能由大到小的顺序为 (填元素符号)。
(4)下图为C元素与钛钙元素形成的某晶体结构中的最小重复单元,该晶体中每个钛原子周围与它最近且距离相等的钙离子有 个,该晶体的化学式为 。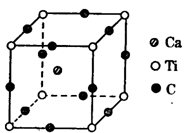
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)写出氯原子的原子结构示意图
(2)氯元素的原子在反应中易 (填“得”或“失”) 个电子,表现出 性。
(3)氯元素的最高化合价为 ,最低化合价为 。
(4)氯元素的非金属性 (填“强”或“弱”)于硫元素的非金属性。
(5)写出氯元素、硫元素最高价氧化物对应水合物的化学式并比较酸性强弱 。
(6)请写出下列物质的电子式。NaCl H2O CO2 N2 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。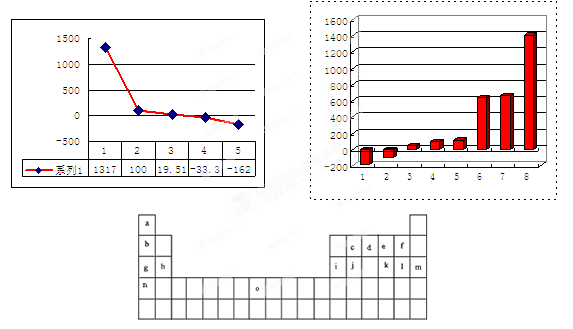
试回答下列问题
(1)元素“O”在周期表中的位置是 。
(2)画出“c”的简化电子排布式 。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表 (填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为: ;序列“1”氢化物的电子式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在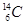 、
、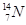 、
、 、
、 、
、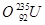 、
、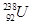 中;
中;
(1) 和 互为同位素
(2) 和 的质量数相等,但不能互称为同位素
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、L、M、N六种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是短周期原子半径最大的元素,N是地壳中含量最高的金属元素。
用化学用语回答下列问题:
(1) M在元素周期表中的位置为 ;六种元素的原子半径从大到小的顺序是
(2)Z、X两元素按原子数目比l∶3构成分子A, A的电子式为 ,Y、L两元素按原子数目比l∶2构成分子B,B中所含的化学键类型为 。
(3)硒(se)是人体必需的微量元素,已知非金属性:34Se<L。请结合原子结构解释原因 。
(4)用Y、L、M构成的正盐溶液可以清除油污,请结合离子方程式以及必要的文字解释原因 。
(5)用石墨作电极,NCl3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q。写出电解熔融Q制取N的电极方程式:阳极: ;阴极: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com