
分析 由银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,则B为Na2O2,A为Na;由将A在空气中露置,最后变成白色固体C,则C为Na2CO3,由A投入水中都生成D,D为NaOH;E是地壳中含量最多的金属元素的单质,应为Al,以此来解答.
解答 解:由银白色固体A在空气中点燃,火焰呈黄色,并生成淡黄色固体B,则B为Na2O2,A为Na;由将A在空气中露置,最后变成白色固体C,则C为Na2CO3,由A投入水中都生成D,D为NaOH;E是地壳中含量最多的金属元素的单质,应为Al,
(1)由以上分析可知,B为Na2O2,C为碳酸钠,E与D溶液反应的化学方程式为2Al+2H2O+2NaOH=2NaAlO2+3H2↑,
故答案为:Na2O2;碳酸钠;2Al+2H2O+2NaOH=2NaAlO2+3H2↑;
(2)首先1molNa与水反应,则:
2Na+2H2O=2NaOH+H2↑
1mol 1mol 0.5mol
然后发生反应2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知1molAl消耗1molNaOH,故Al与NaOH恰好完全反应,生成氢气为1mol×$\frac{3}{2}$=1.5mol,
故生成氢气的总体积为(0.5mol+1.5mol)×22.4L/mol=44.8L,
故答案为:44.8L;
(3)最后残留固体的质量与加入的铁粉的质量相等,则反应Fe+CuSO4=Cu+FeSO4导致固体增重等于反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量,
假定反应Fe+H2SO4=FeSO4+H2↑中参加反应的Fe的质量为56g,其物质的量为1mol,由方程式可知n(H2SO4)=n(Fe)=1mol,
Fe+CuSO4=Cu+FeSO4 固体增重△m
1mol 64g-56g=8g
n(CuSO4) 56g
故n(CuSO4)=$\frac{56g}{8g}$×1mol=7mol,
故原溶液中c(H+):c(SO42-)=1mol×2:(1mol+7mol)=1:4,
故答案为:1:4.
点评 本题考查无机物的推断,为高频考点,把握钠及其化合物的性质、发生的反应及现象为解答的关键,侧重分析与推断能力的考查,注意B为推断的突破口,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
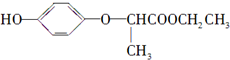 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )| A. | 1 mol HPE最多可和2 mol NaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | HPE不能发生加成反应 | |
| D. | HPE在核磁共振氢谱中有6个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 2mol SO2、1mol O2 | 2mol SO3 | m mol SO2、n mol O2、p mol SO3 |
| c(SO3)/mol•L-1 | 1.4 | 1.4 | 1.4 |
| 能量变化 | 放出a kJ | 吸收b kJ | 吸收c kJ |
| SO2或SO3的转化率 | α1 | α2 | 12.5% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 盐酸体积(mL) | 5 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 224 | 448 | 1792 | 4480 | 4480 | 4480 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状况下,1mol水和1molH2的体积都约是22.4L | |
| B. | 2gH2和44gCO2的体积相等 | |
| C. | 1mol某气体的体积为22.4L,则该气体一定处于标准状况 | |
| D. | 在标准状况下,1gH2和11.2LO2的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验序号 | c(NH4Cl)/mol.L-1 | 温度/℃ | 待测物理量 | 实验目的 |
| Ⅰ | 0.5 | 30 | x | - |
| Ⅱ | 1.5 | i | y | 探究浓度对氯化铵水解平衡的影响 |
| Ⅲ | 0.5 | 35 | z | ii |
| Ⅳ | 2.0 | 40 | m | 探究温度、浓度同时对氯化铵水解平衡的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 10 | 20 | 30 | 40 | 50 | 60 |
| n(CH3OH)/mol | 0.080 | 0.120 | 0.150 | 0.168 | 0.180 | 0.180 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com