
【题目】关于化学能与其他能量相互转化的说法正确的是( )

A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 中和反应中,反应物的总能量比生成物的总能量低
D. 化学反应中能量变化的主要原因是化学键的断裂与形成
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】臭氧是地球大气中一种微量气体,人类正在保护和利用臭氧。
(1)氮氧化物会破坏臭氧层,已知:
①NO(g) + O3(g)![]() NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
NO2(g) + O2 (g) ΔH1 = 200.9 kJ·mol1
②2NO(g) +O2 (g)![]() 2NO2 (g) ΔH 2 = 116.2 kJ·mol1
2NO2 (g) ΔH 2 = 116.2 kJ·mol1
则反应:2O3(g)![]() 3O2 (g) ΔH=______。
3O2 (g) ΔH=______。
(2)实验室将氧气和臭氧的混合气体0.896 L(标准状况)通入盛有20.0 g铜粉的反应器中,加热充分反应后,粉末的质量变为21.6 g。则原混合气中臭氧的体积分数为______。
(3)大气中的部分碘源于O3对海水中I—的氧化。将O3持续通入NaI溶液中进行模拟研究,探究Fe2+对氧化I—反应的影响,反应体系如图1,测定两组实验中I3—浓度实验的数据如图2所示:
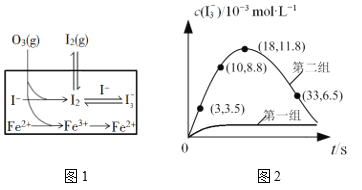
①反应后的溶液中存在化学平衡:I2(aq)+I(aq) ![]() I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
I3-(aq),当c(I3-)/c(I-)=6.8时,溶液中c(I2)=______。(已知反应的平衡常数K=680)
②结合实验数据可知,Fe2+对I的转化率的影响是_____(填“增大”“无影响”或“减小”)。
③第二组实验18 s后,I3—浓度下降。导致I3—浓度下降的原因是_____。
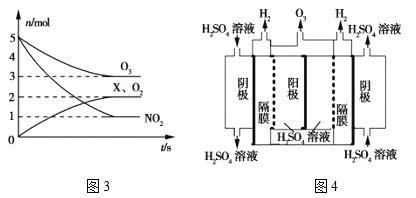
(4)臭氧是一种杀菌消毒剂,还是理想的烟气脱硝剂。
①一种脱硝反应中,各物质的物质的量随时间的变化如图3所示,X为___(填化学式)。
②一种臭氧发生装置原理如图4所示。阳极(惰性电极)的电极反应式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浅绿色的硝酸亚铁溶液存在如下平衡:Fe2++2H2OFe(OH)2+2H+,若在此溶液中加入盐酸,则溶液的颜色( )
A.变深B.变浅C.变黄D.不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H除外):____,所含元素的原子半径由小到大的顺序:_____,Mg在元素周期表中的位置:_______,Mg(OH)2的电子式:_____
(2)在NaCl、NaOH、N2、H2S中,只含有离子键的是____,仅含有共价键的化合物是_______
(3)用电子式表示MgCl2的形成过程___________
(4)将锌片和银片浸入稀硫酸中组成原电池,若该电池中两电极的总质量为60g,工作一段时间后,取出锌片和银片洗净,干燥后称重,总质量为47g,则产生氢气的体积___mL(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应A(g)+B(g)=C(g)+D(g),过程中的能量变化如图所示,下列说法中正确的是( )
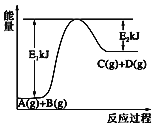
A. A的能量一定低于C
B. 反应物断键吸收的总能量大于产物新键形成放出的总能量
C. 化学反应中的能量变化都表现为热量的变化
D. 1mol气体A和1mol气体B反应生成1mol气体C和1molD
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无需其他操作,仅将①中物质加入(或通入)②中,预测的实验现象与实际相符的是
选项 | ① | ② | 预测现象 |
A | 久置氯水 | 紫色石蕊溶液 | 溶液先变红后褪色 |
B | 浓盐酸 | 二氧化锰 | 产生黄绿色气体 |
C | 二氧化碳气体 | 水玻璃 | 产生白色沉淀 |
D | 硫氰化钾溶液 | 氯化铁溶液 | 产生血红色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H八种短周期主族元素在周期表中的相对位置如下图所示,已知C元素形成的单质有“国防金属”的美誉,E的最高价氧化物对应的水化物能与E的最简单氢化物反应生成离子化合物。
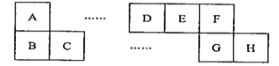
(1)D元素在周期表中的位置为______________。
(2)B、E、F的简单离子半径由大到小的顺序为______________(写离子符号)。
(3)上述元素所形成的气态单质中能用于饮用水消毒的是_________(写化学式)。
(4)F与G的氢化物中稳定的是________(写化学式)。
(5)B的单质在F的单质中燃烧所形成化合物的电子式为________。
(6)写出实验室制备E的最简单氢化物的化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表短周期的一部分:

请按要求用化学用语回答下列问题:
(1)元素④、⑥、⑨的离子半径由大到小的顺序为________________;
(2)元素②、③、④的简单氢化物的沸点由低到高的顺序: _____________________;
(3)用电子式表示元素④与元素⑥形成的化合物的形成过程____________;
(4)比元素⑦的原子序数多17的元素在周期表的位置为________________;
(5)写出由①④⑤三种元素组成的一种离子化合物的电子式_______________,若将其溶于水,破坏了其中的__________(填“离子键”、“共价键”或“离子键和共价键”);
(6)元素①和元素④形成的化合物及元素①和元素⑧形成的化合物均为18电子分子,请写出这两种化合物按物质的量之比4:1反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】F 是重要的有机化合物,可以由基础化合物 A 通过以下过程制得:
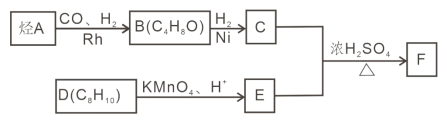
已知:①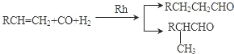
②核磁共振氢谱显示 C 的分子中含有 4 种不同化学环境的氢原子,且其峰面积之比为6:1:2:1;
③F是酯类化合物,分子中苯环上的一溴取代物只有两种。
(1)A 发生加聚反应的化学方程式是_____。
(2)B 物 质 的 名 称 为 _____; 检 验 B 中 官 能 团 的 实 验 操 作 方法___________。
(3)F 中的官能团的名称为_____;C+E→F 的化学方程式是_____。
(4)X 与 E 互为同分异构体,且 X 具有下列性质,符合条件的 X 有_____种(不考虑立体异构)。
①分子中含有苯环,且能与 NaHCO3 溶液反应生成二氧化碳气体
②与银氨溶液共热有银镜生成。
(5)设计由乙烯和必要的无机原料合成丙酸乙酯的合成路线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com