

分析 (1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
根据盖斯定律,①+2×②-③得:CO(g)+2H2(g)═CH3OH(g),△H=△H1+2△H2-△H3;
(2)①由图象可知,相同温度下,P2压强下一氧化碳转化率大于P1压强下的转化率,正反应是气体体积减小的反应,压强增大平衡正向进行,CO转化率增大;
②A点CO的转化率为0.75,则转化的CO为0.75a mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):0.75a 1.5a 0.75a
平衡量(mol):0.25a 0.5a 0.75a
再根据平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$计算;
③CO和H2按照物质的量比1:2反应,而开始充入a molCO与2a molH2也刚好为1:2,所以CO的转化率等于H2的转化率;
④a.使用高效催化剂不影响平衡移动;
b.降低反应温度会减慢反应速率;
c.增大体系压强,增大反应速率,而且平衡也向正反应方向移动;
d.不断将CH3OH从反应混合物中分离出来,即减小生成物的浓度,则反应速率减小;
e.增加等物质的量的CO和H2,即增大反应物的浓度,反应速率增大,但CO的转化率减小;
(3)负极发生氧化反应,由图可知,负极上是二氧化硫氧化生成硫酸;
(4)阳极发生氧化反应,电解开始是HSO3-失去电子被氧化生成SO42-.
解答 解:(1)(1)已知:①CO(g)+$\frac{1}{2}$O2(g)═CO2(g)△H1=-283.0kJ•mol-1
②H2(g)+$\frac{1}{2}$O2(g)═H2O(I)△H2=-285.8kJ•mol-1
③CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(I)△H3=-764.5kJ•mol-1
根据盖斯定律,①+2×②-③得:CO(g)+2H2(g)═CH3OH(g),△H=△H1+2△H2-△H3=(-283.0-285.8×2+764.5)kJ•mol-1=-90.1kJ•mol-1,
故答案为:-90.1;
(2)①由图象可知,相同温度下,P2压强下一氧化碳转化率大于P1压强下的转化率,甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高,所以P1<P2,
故答案为:<;甲醇的合成反应是气体分子数减少的反应,相同温度下,增大压强CO的转化率提高;
②A点CO的转化率为0.75,则转化的CO为0.75a mol,则:
CO(g)+2H2(g)?CH3OH(g)
起始量(mol):a 2a 0
变化量(mol):0.75a 1.5a 0.75a
平衡量(mol):0.25a 0.5a 0.75a
则平衡常数K=$\frac{c(C{H}_{3}OH)}{c(CO)×{c}^{2}({H}_{2})}$=$\frac{\frac{0.75a}{V}}{\frac{0.25a}{V}×(\frac{0.5a}{V})^{2}}$=$\frac{12{V}^{2}}{{a}^{2}}$,
故答案为:$\frac{12{V}^{2}}{{a}^{2}}$;
③CO和H2按照物质的量比1:2反应,而开始充入a molCO与2a molH2也刚好为1:2,所以CO的转化率等于H2的转化率,
故答案为:=;
④a.使用高效催化剂加快反应速率,但不影响平衡移动,CO转化率不变,故a错误;
b.降低反应温度平衡正向移动,CO转化率增大,但会减慢反应速率,故b错误;
c.增大体系压强,增大反应速率,而且平衡也向正反应方向移动,CO转化率增大,故c正确;
d.不断将CH3OH从反应混合物中分离出来,平衡正向移动,CO转化率增大,但减小生成物的浓度,反应速率减小,故d错误
e.增加等物质的量的CO和H2,即增大反应物的浓度,反应速率增大,但CO的转化率减小,故e错误,
故选:c;
(3)负极发生氧化反应,由图可知,负极上是二氧化硫氧化生成硫酸,负极电极反应式为:SO2-2e-+2H2O═SO42-+4H+,
故答案为:SO2-2e-+2H2O═SO42-+4H+;
(4)阳极发生氧化反应,电解开始是HSO3-失去电子被氧化生成SO42-,阳极电极反应式为:HSO3-+H2O-2e-=SO42-+3H+,
故答案为:HSO3-+H2O-2e-=SO42-+3H+.
点评 本题考查化学平衡计算、化学平衡影响因素、反应热计算、电极反应式书写等,较好的考查学生分析能力、知识运用与获取信息的能力,题目难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 0.5mol | B. | 0.7mol | C. | 0.8mol | D. | 0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
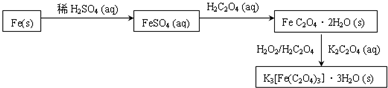
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下:
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸.反应原理如下: +2KMnO4$\stackrel{△}{→}$
+2KMnO4$\stackrel{△}{→}$ +KOH+2MnO2+H2O
+KOH+2MnO2+H2O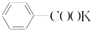 +HCl→
+HCl→ +KCl
+KCl
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质的电离是一个吸热过程,升温其电离度增大 | |
| B. | 某些盐类的水解是一个吸热过程,升温水解程度增大 | |
| C. | 溶液的酸碱性取决于溶液中氢离子浓度的大小 | |
| D. | 酸性溶液不一定是酸溶液,碱性溶液不一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用装置甲制取二氧化硫气体 | |
| B. | 用装置乙收集二氧化硫气体 | |
| C. | 用适量CuO粉末中和反应后溶液,用装置丙过滤 | |
| D. | 用装置丁蒸发浓缩CuSO4溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com