
【题目】关于胶体和溶液的叙述中正确的是
A. 胶体带电荷,而溶液呈电中性
B. 胶体粒子的直径大小在1-100纳米之间
C. 胶体加入电解质可产生沉淀,而溶液不能
D. 从颜色上无法区别FeCl3溶液和Fe((OH)3胶体
科目:高中化学 来源: 题型:
【题目】据统计,每年由于腐蚀而直接损耗的金属材料约占金属年产量的10%.下列措施中,不能防止金属腐蚀的是( )
A.在金属表面涂一层油漆
B.在金属表面涂机油
C.在金属表面涂食盐溶液
D.在金属表面镀一层不活泼金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种重要的污水处理剂,具有易与水反应、易被氧化的性质。某兴趣小组在实验室中制备无水FeCl2并测定其纯度,设计了如下实验(夹持装置已略去,I中各装置不重复使用)。
Ⅰ.FeCl2的制备
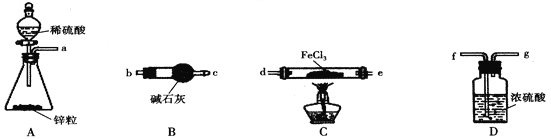
(1)加热条件下,H2与FeCl3制备无水FeCl2的化学方程式为______________________。
(2)按气流从左到右的方向,上图中装置合理的连接顺序为_________________(用仪器接口处的字母表示)。
(3)装置B的作用为____________。
(4)反应结束后,应先熄灭C处的酒精灯还是先关闭A处分液漏斗的活塞_______________(填“熄灭酒精灯”或“关闭活塞”)。
Ⅱ.FeCl2的纯度测定
已知:①实验得到固体的成分为FeCl2和FeCl3。
②Fe3+与K3[Fe(CN)6]不反应,3Fe2++2 [Fe(CN)6]3-![]() Fe3[Fe(CN)6]2↓。
Fe3[Fe(CN)6]2↓。
该兴趣小组设计了如下实验测定得到的FeCl2和FeCl3混合物中FeCl2的纯度。
(i)称取m g反应后的固体溶于过量盐酸中,再将所得溶液加水稀释到200 mL。
(ii)准确量取20 mL上述溶液于烧杯中,加入过量的K3[Fe(CN)6]溶液,有蓝色的Fe3[Fe(CN)6]2沉淀生成。
(iii)过滤、洗涤、干燥后进行称量,得到W g蓝色固体。
(5)产品中FeCl2的质量分数为____________________________(用含有m和ω的式子表示)。甲同学认为按照上述方案测得的FeCl2的质量分数偏低,他的理由为______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是( )
A.溶液快速褪色B.溶液缓慢褪色C.生成白色沉淀D.生成浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某溶液浸湿滤纸后置于集气瓶口,以检验瓶中是否收集满二氧化硫气体。则该溶液是( )
A.氯化钡溶液B.酸性高锰酸钾溶液
C.碘化钾淀粉溶液D.澄清石灰水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如下图所示.已知海水中含Na+、Cl﹣、Ca2+、Mg2+、SO ![]() 等离子,电极为惰性电极.下列叙述中正确的是( )
等离子,电极为惰性电极.下列叙述中正确的是( ) 
A.A膜是阳离子交换膜
B.通电后,海水中阴离子往b电极处运动
C.通电后,b电极上产生无色气体,溶液中出现白色沉淀
D.通电后,a电极的电极反应式为4OH﹣﹣4e﹣═O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁、铝及其化合物在生产生活中具有重要的应用.回答下列问题:
(1)工业上冶炼金属镁是采用惰性电极电解熔融MgCl2的方法,此时阴极的电极反应式为:;
(2)除去MgCl2溶液中的Fe2+ , 常加入少量H2O2 , 使Fe2+氧化为Fe3+ , 然后加入少量碱性物质至溶液pH=4,此时c(Fe3+)=mol/L[已知Fe(OH)3的Ksp=4×10﹣38]
(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,关于为什么不采用电解熔融AlCl3的方法的叙述正确的是(选择填空):
A.AlCl3是非电解质
B.AlCl3水溶液不导电
C.AlCl3是共价化合物
D.AlCl3熔点太高
(4)用碳棒做电极电解熔融Al2O3时,阳极需要定期更换,其原因是(用电极反应式和化学方程式回答);
(5)已知:Al2O3(熔融,l)=2Al(s)+ ![]() O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
(6)明矾的化学式为KAl(SO4)212H2O,它可以作为净水剂,用离子方程式表示其能够净水的原因;向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7(填>、<、=);
(7)若在空气中加热固体MgCl26H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 , 所以,为了抑制MgCl26H2O在加热时水解,可在干燥的气流中加热,可得到无水氯化镁.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com