
【题目】(15分)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的还原产物为____________。
(2)上述浓缩液中含有I-、Cl-等离子,取一定量的浓缩液,向其中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中![]() 为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
为:_____________,已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17。
(3)已知反应2HI(g) ===H2(g) + I2(g)的ΔH= +11kJ·mol-1,1mol H2(g)、1mol I2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为______________kJ。
(4)Bodensteins研究了下列反应:2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正= k正·x2(HI),逆反应速率为v逆=k逆·x(H2)·x(I2),其中k正、k逆为速率常数,则k逆为________(以K和k正表示)。若k正 = 0.0027min-1,在t=40min时,v正=________min-1
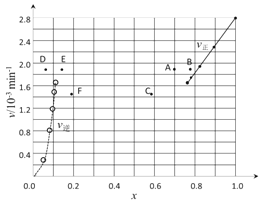
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2/span>)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为_________________(填字母)
【答案】(1)MnSO4;
(2)4.7×10-7;
(3)299
(4)①![]() ;②k逆= k正/K;1.95×10-3;③ A、E
;②k逆= k正/K;1.95×10-3;③ A、E
【解析】
(1)问中根据氧化还原反应方程式来判断还原产物是中学常规考法,迁移实验室制氯气的原理可得MnSO4。
(2)体系中既有氯化银又有碘化银时,存在沉淀转化平衡:AgI(s) +Cl-![]() AgCl(s) +I-。
AgCl(s) +I-。
![]()
分子、分母同时乘以![]() ,有:
,有:![]() ,将Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17代入得:
,将Ksp(AgCl)=1.8×10-10,Ksp(AgI)=8.5×10-17代入得:![]() 。
。
(3)键能一般取正值来运算,ΔH=E(反应物键能总和)-E(生成物键能总和);设1molHI(g)分子中化学键断裂时需吸收的能量为xkJ,代入计算:+11=2x-(436+151)
x =299
(4)①问中的反应是比较特殊的,反应前后气体体积相等,不同的起始态很容易达到等效的平衡状态。大家注意表格中的两列数据是正向和逆向的两组数据。
716K时,取第一行数据计算:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
n(始)(取1mol) 1 0 0
Δn (0.216) (0.108) (0.108)
n(平) 0.784 (0.108) (0.108)
化学平衡常数为![]()
本小题易错点:计算式会被误以为是表达式。
②问的要点是:平衡状态下,v正= v逆,故有:k正·x2(HI) = k逆·x(H2)·x(I2)
变形:k正/ k逆={ x(H2)·x(I2)}/ x2(HI)=K
故有: k逆= k正/K
③ 问看似很难,其实注意到升温的两个效应(加快化学反应速率、使平衡移动)即可突破:先看图像右半区的正反应,速率加快,坐标点会上移;平衡(题中已知正反应吸热)向右移动,坐标点会左移。综前所述,找出A点。同理可找出E点。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质的分类或归类正确的一组是( )
①液氨、液氧、干冰、纯碱均为化合物 ②盐酸、氢氧化铁胶体、空气、氨水均为混合物 ③氢氧化钾、小苏打、硫酸、烧碱均为电解质 ④碘酒、牛奶、豆浆、肥皂水均为胶体 ⑤![]() 、
、![]() 、
、![]() 、
、![]() 均为钠盐
均为钠盐
A.①和②B.②和③C.②和④D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的是( )
A. SO32- 和NO2-B. NO3- 和SO32-C. ![]() 和ClO3-D. PO43- 和SO32-
和ClO3-D. PO43- 和SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)请写出A装置中发生反应的化学方程式_____。
(2)饱和食盐水的作用是_____。
(3)装置B中盛放的试剂是_____(选填下列所给试剂的代码),反应离子方程式是_____。
A.N![]() S溶液 B.N
S溶液 B.N![]() S
S![]() 溶液 C.N
溶液 C.N![]() S
S![]() 溶液
溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强_____(填编号)
①HCl比![]() S稳定 ②HClO氧化性比
S稳定 ②HClO氧化性比![]() S
S![]() 强 ③HCl
强 ③HCl![]() 酸性比
酸性比![]() S
S![]() 强 ④HCl酸性比
强 ④HCl酸性比![]() S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C
S强 ⑤氯原子最外层有7个电子,硫原子最外层有6个电子 ⑥铁与C![]() 反应生成FeC
反应生成FeC![]() ,而硫与铁反应生成FeS
,而硫与铁反应生成FeS
(5)此装置有多种用途,若用此装置验证氯元素的非金属性比碘元素的强,需要在B装置中加入KI溶液,通入一段时间气体后向B中加入少量CC![]() ,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
,振荡。能够证明氯元素的非金属性比碘元素的强的实验现象是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含500mL 0.8 mol/L 的Al2(SO4)3中所含的SO![]() 的物质的量是___________。
的物质的量是___________。
(2)标准状况下,___________ L NH3所含氢原子数与0.2molH3PO4所含氢原子数相等。
(3)将20ml物质的量浓度为6mol/L的MgSO4加水稀释成100ml溶液,所得稀硫酸的物质的量浓度是_____________。
(4)a个X原子的总质量为bg,则X的相对原子质量可以表示为_______________。
(5)同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比为__________,质量之比为__________。
(6)等质量的 SO2 和 SO3 物质的量之比是____________,氧原子数之比为____________。
(7)25.4 g某二价金属A的氯化物中含有0.4mol Cl-,则A的摩尔质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途。请回答下列问题:
(1)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 ;

(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为 ;
(3)Se原子序数为 ,其核外M层电子的排布式为 ;
(4)H2Se的酸性比H2S (填“强”或“弱”)。气态SeO3分子的立体构型为 ,SO32-离子的立体构型为 ;
(5)H2SeO3的K1和K2分别为2.7x l0-3和2.5x l0-8,H2SeO4第一步几乎完全电离,K2为1.2X10-2,请根据结构与性质的关系解释:
①H2SeO3和H2SeO4第一步电离程度大于第二步电离的原因:
;
② H2SeO4比 H2SeO3酸性强的原因:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对矿井下空气进行氧气含量测定既能保证矿工的身体健康又能为瓦斯灾害处理提供数据。缺氧场所常采用伽伐尼电池型氧传感器检测氧气浓度,该传感器结构如图所示,工作电极为Pb,对比电极为Pt,电池液为KOH溶液。下列说法不正确的是

A.氧在对比电极被还原
B.工作电极的电极反应为Pb+2OH--2e-=Pb(OH)2
C.外电路电子由对比电极流向工作电极
D.该传感器测定氧气浓度时不需外加电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,下列叙述不正确的是( )

A.Pb的最高正价为+4B.原子半径比较:Al>F
C.酸性强弱:H3AsO4<H2SeO4D.Br的最高价氧化物对应水化物的化学式为HBrO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外兴趣小组为探究足量的铜跟浓硫酸的反应情况,用下图所示装置进行有关实验。
已知:①SO2难溶于饱和亚硫酸氢钠溶液。②SO2能与酸性高锰酸钾溶液发生氧化还原反应。请回答下列问题:
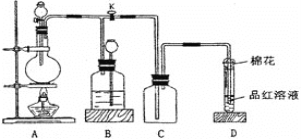
(1)装置A中发生的化学反应方程式为____________;此反应表明浓硫酸具有_________(填字母)。
a. 酸性 b. 脱水性 c. 强氧化性 d. 吸水性
(2)装置D中试管口放置的棉花中浸入__________溶液,其作用是_____________。
(3)装置B的作用是贮存多余的气体,B中应放置的液体是__________(填字母)。
a. 水 b. 饱和NaHSO3溶液 c. 酸性KMnO4溶液 d. NaOH溶液
(4)实验中,取一定质量的铜片和一定体积18.4 mol·L-1的浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。
①有一定量的余酸但未能使铜片完全溶解,你认为原因是____________。
②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是___________(填字母)。
a. 银粉 b. 铁粉 c. BaCl2溶液 d. NaHCO3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com