
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
分析 设Cu的物质的量为x,Al的物质的量为y,n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由质量及原子守恒可知,
$\left\{\begin{array}{l}{64x+27y=12.3g}\\{2x+3y=0.2×(5-2)}\end{array}\right.$,
解得y=0.1mol,x=0.15mol,
结合Cu~Cu(NO3)2~2NaOH、Al~Al(NO3)3~3NaOH及c=$\frac{n}{V}$计算.
解答 解:设Cu的物质的量为x,Al的物质的量为y,n(NO)=$\frac{4.48L}{22.4L/mol}$=0.2mol,由质量及原子守恒可知,
$\left\{\begin{array}{l}{64x+27y=12.3g}\\{2x+3y=0.2×(5-2)}\end{array}\right.$,
解得y=0.1mol,x=0.15mol,
由Cu~Cu(NO3)2~2NaOH、Al~Al(NO3)3~3NaOH可知,
消耗NaOH为0.6mol,
消耗氢氧化钠溶液的体积最多为200mL,则氢氧化钠溶液的浓度为$\frac{0.6mol}{0.2L}$=3mol/L,
故选B.
点评 本题考查氧化还原反应的计算,为高频考点,把握电子及质量守恒为解答的关键,侧重分析与计算能力的考查,注意NaOH的物质的量等于金属失去电子的物质的量,题目难度不大.


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
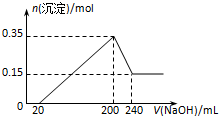 将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )
将一定质量的镁和铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示..则下列说法不正确的是( )| A. | 镁和铝的总质量为9 g | |
| B. | 最初20 mLNaOH溶液用于中和过量的硫酸 | |
| C. | 硫酸的物质的量浓度为5 mol•L-1 | |
| D. | 生成的氢气在标准状况下的体积为11.2 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
| 将氨水滴到氯化铝溶液中至过量 | 将二氧化碳逐渐通入氯水中至过量 | 将铜粉加入到浓硝酸中至过量 | 卤族元素的氧化物沸点随核电荷数的变化 |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物质能来源于植物及其加工产品所存贮的能量,绿色植物通过光合作用将化学能转化成生物质能 | |
| B. | 2015年8月国内油价再次迎来成品油最高零售价的下调,上演了年内首场“四连跌”,但油品从国Ⅳ汽油升级到Ⅴ汽油,有助于减少酸雨、雾霾,提高空气质量 | |
| C. | 我国已能利用3D打印技术,以钛合金粉末为原料,通过激光熔化逐层堆积,来制造飞机钛合金结构件,高温下可用金属钠还原四氯化钛来制取金属钛 | |
| D. | 元素分析仪可以确定物质中是否含有C、H、O、N、S、Cl、Br等元素,原子吸收光谱可以确定物质中含有哪些金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
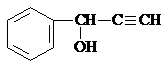 、
、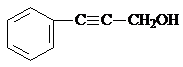 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com