
分析 F-是氟原子得一个电子形成的;
Na+是钠原子失去一个电子形成的;
Mg2+是镁原子失去2个电子形成的;
Al3+是铝原子失去3个电子形成的;
S2-是硫原子得2个电子形成的;
Cl-是氯原子得一个电子形成的.
而在原子得失电子的时候,质子数、核电荷数不变.据此分析.
解答 解:原子得失电子的时候,质子数、核电荷数不变.
F-是氟原子得一个电子形成的,故结构示意图为 ;
;
Na+是钠原子失去一个电子形成的,故结构示意图为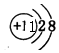 ;
;
Mg2+是镁原子失去2个电子形成的,故镁离子的结构示意图为 ;
;
Al3+是铝原子失去3个电子形成的,故结构示意图为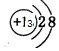 ;
;
S2-是硫原子得2个电子形成的,故硫离子的结构示意图为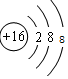 ;
;
Cl-是氯原子得一个电子形成的,故氯离子的结构示意图为 ;
;
答:F-、Na+、Mg2+、Al3+、S2-、Cl-的离子结构示意图分别为 、
、 、
、 、
、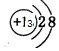 、
、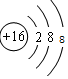 、
、 ;
;
点评 明确常见元素的原子序数,会书写常见元素原子或离子结构示意图,并了解元素原子得失电子的特点是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 18gH2O含有的氢分子数目为NA | |
| B. | 标准状况下,22.4LCCl4含有的分子数目为NA | |
| C. | 1L 1mol•L-1K2SO4溶液中含有的钾离子数目为NA | |
| D. | 1mol Fe与足量的稀盐酸反应,失去的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验设计或操作 | 观察或记录 | 结论或解释 |
| A | 向足量含淀粉的FeI2溶液中滴加2滴氯水 | 溶液变蓝 | 还原性:I->Fe2+ |
| B | 向10mL 0.2mol/L AgNO3溶液中滴入2滴0.1mol/L NaCl溶液,产生白色沉淀后,再滴加2滴0.1mol/LKI溶液 | 白色沉淀转化为黄色沉淀 | 证明在相同温度下的Ksp:AgCl>AgI |
| C | 浓硫酸滴入蔗糖中,并搅拌 | 得黑色蓬松的固体并有刺激性气味气体 | 该过程中浓硫酸仅体现吸水性和脱水性 |
| D | 把SO2通入橙色的溴水中 | 橙色褪去 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.5mol•L-1 | B. | 3mol•L-1 | C. | 3.5mol•L-1 | D. | 4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.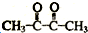 ,A→B的反应类型为氧化反应.
,A→B的反应类型为氧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
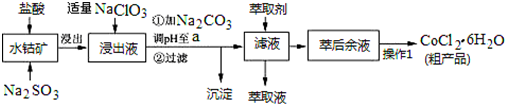
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
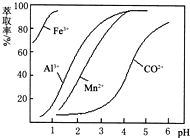
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2mol H2完全燃烧时液态水放热572kJ | |
| B. | 相同条件下,2mol H2O完全分解吸收热量572kJ | |
| C. | 相同条件下,1mol H2充分燃烧生成气态水放热大于286kJ | |
| D. | 形成1mol H2O的化学键所释放的能量大于断裂lmol H2和0.5mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入10mL 的水进行稀释 | B. | 加水稀释成100mL | ||
| C. | 加入45mL 0.01mol/L的NaOH溶液 | D. | 加入10mL 0.01mol/L的盐酸溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com