
| A. | 汽车尾气中的CO﹑NO等都是大气污染物 | |
| B. | 氢键﹑离子键﹑共价键都是微粒间的作用力,且属于化学键 | |
| C. | 高压钠灯发出的黄光射程远,透雾能力强,常用于道路和广场的照明 | |
| D. | 用食醋可以除去热水壶内壁的水垢 |
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中SO42-的方法是:先加入BaCl2溶液,再加盐酸 | |
| B. | 从溴水中提纯单质溴的方法是:先用CCl4萃取,分液后再蒸馏 | |
| C. | 硫化钠溶液中通入硫化氢气体不发生化学反应 | |
| D. | 除去CO2中少量HCl的方法是:将混合气体通过盛有饱和NaHSO3溶液的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Mg2+、I-、NO3-在无色溶液中能大量共存 | |
| B. | K+、Na+、CO32-、NO3-在酸性溶液中不能大量共存 | |
| C. | CO2与少量烧碱溶液反应:CO2+2OH-=CO32-+H2O | |
| D. | 向AlCl3溶液中加入过量的氨水溶液Al3++3NH3.H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
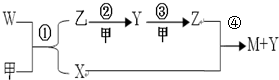
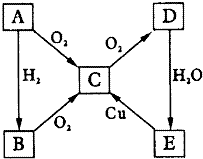 如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:
如图所示转化关系,A为单质,试对下列情况进行推断,并回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.
A、B、C、D四种元素的核电荷数均小于18,A元素原子核外只有1个电子;B是地壳中含量最多的元素;B、C可形成两种化合物CB和CB2,C的最高正价与最低负价绝对值相等,CB有毒,CB2可用于灭火;D+具有与Ne原子相同的电子层结构.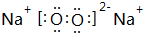 ,CB2的电子式 为
,CB2的电子式 为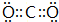 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| B | C | D | |
| E |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验 操作 | 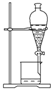 | 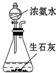 | 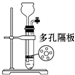 | 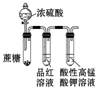 |
| 实验 目的 | 分离乙酸与乙酸乙酯的混合液 | 制取氨气 | 盐酸与碳酸钙反应,验证碳与氯的非金属性强弱 | 验证浓硫酸具有脱水性、强氧化性,SO2具有漂白性、氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +3、+5、-3 | -2 |
| A. | Z的最高价氧化物对应水化物与其氢化物能发生化合反应生成离子化合物 | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 相同条件下,X、Y的单质分别与盐酸反应时,后者反应剧烈些 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com