
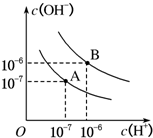
分析 (1)水的电离是吸热反应,升高温度促进水电离,水中c(H+)、c(OH-)都增大;
(2)25℃时,将pH=9的NaOH溶液中c(OH-)=10-5 mol/L,pH=4的H2SO4溶液中c(H+)=10-4 mol/L,要使混合溶液呈中性,则n(OH-)=n(H+);
;
(3)99℃时,pH1=a的某强酸溶液中C(H+)=10-a mol/L,pH2=b的某强碱溶液C(OH-)=10b-12 mol/L,溶液呈中性,则酸中 n(H+)应等于碱中n(OH-);
(4)pH=3的盐酸溶液和pH=9的某碱溶液等体积混合后,氢离子和氢氧根离子恰好反应.
解答 解:(1)纯水中,水的电离是吸热反应,升高温度促进水电离,c(OH-)、c(H+)增大且c(OH-)=c(H+),水的离子积常数增大,所以25℃时水的电离平衡曲线应为A,故答案为:A;温度越高Kw越大;
(2)25℃时,将pH=9的NaOH溶液中C(OH-)=10-5 mol/L,pH=4的H2SO4溶液中C(H+)=10-4 mol/L,要使混合溶液呈中性,则氢氧根离子的物质的量等于氢离子的物质的量,设碱的体积为xL,酸的体积为yL,则10-5 mol/L×xL=10-4 mol/L×yL,
所以x:y=10-4:10-5=10:1,
故答案为:10:1;
(3)99℃时,pH1=a的某强酸溶液中C(H+)=10-a mol/L,pH2=b的某强碱溶液C(OH-)=10b-12 mol/L,溶液呈中性,则酸中氢离子的物质的量应等于碱中氢氧根离子的物质的量,所以100×10-a=1×10b-12,a+b=14,即pH1+pH2=14,故答案为:pH1+pH2=14;
(4)曲线B对应温度下,pH=2的盐酸溶液和pH=10的某BOH溶液等体积混合后,氢离子和氢氧根离子恰好反应,如果碱是强碱,则盐溶液呈中性,实际上溶液呈碱性,则碱为弱碱,生成强酸弱碱盐水解呈碱性,中和后混合溶液中还剩余较多的弱碱分子,可继续电离出OH-,使溶液呈碱性,
故答案为:BOH为弱碱,c(BOH)?c(HCl),等体积混合两溶液时,BOH过量,反应后溶液呈碱性.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查分析计算能力,明确酸碱溶液混合时酸碱的物质的量关系及混合溶液pH的计算方法是解本题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 滴定管、移液管以及滴定过程中用于盛待测液的锥形瓶,使用前都需要洗涤与润洗 | |
| B. | 实验室制取氯气时,先装好二氧化锰,再检查装置的气密性 | |
| C. | 检验红色砖块中是否含三价铁的步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液 | |
| D. | 在中和热测定的实验中,将氢氧化钠溶液和盐酸混合反应后的最高温度作为末温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
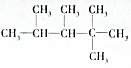 的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.
的烷烃,则此烯烃可能的结构简式是CH2=CHCH3CHCH3C(CH3)3、(CH3)2C=CCH3C(CH3)3、(CH3)2CHC=CH2C(CH3)3.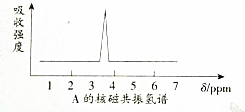
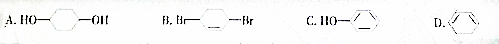
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
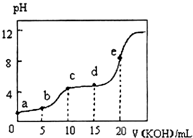 常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )
常温下,用0.10mol•L-1KOH溶液滴定10.00mL 0.10mol•L-1某二元弱酸H2R溶液,所得滴定曲线如图所示.下列叙述正确的是( )| A. | a点所示溶液中:$\frac{c({H}^{+})}{c(O{H}^{-})}$<1012 | |
| B. | c点所示溶液中:c(K+)>c(HR-)>c(H2R)>c(R2-) | |
| C. | e点所示溶液中:c(H+)=c(HR-)+2c(H2R)+c(OH-) | |
| D. | 五个点中d点时c(HR-)最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | H2SO3 | HSO3- | H2CO3 | HCO3- |
| PKa | 1.9 | 7.2 | 6.4 | 10.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
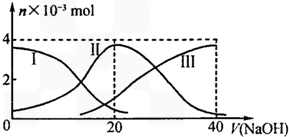 25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )
25℃时,向20mL0.2mol/LH2A溶液中滴加0.2mol/LNaOH溶液.有关微粒物质的量变化如图(其中I代表H2A,II代表HA-,III代表A2-).根据图示判断下列说法正确的是( )| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 | |
| B. | 向Na2A溶液加入水的过程中,pH可能增大也可能减小 | |
| C. | 欲使NaHA溶液呈中性,可以向其中加入酸 | |
| D. | 当V(NaOH)=20mL时,溶液中离子浓度大小关系:[Na+]>[HA-]>[H+]>[A2-]>[OH-] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应后盐水解使溶液呈碱性 | B. | 弱酸溶液和强碱溶液反应 | ||
| C. | 强酸溶液和弱碱溶液反应 | D. | 一元强酸溶液和一元强碱溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
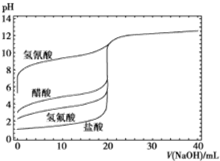 如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )
如图是用0.1mol/LNaOH溶液分别滴定20mL浓度均为0.1mol/L的不同一元酸的滴定曲线,下列说法错误的是( )| A. | 酸性:HF>CH3COOH>HCN | |
| B. | 用NaOH溶液滴定醋酸时,应用酚酞做指示剂不能使用甲基橙 | |
| C. | 当加入10mLNaOH溶液时,c(CN-)>c(CH3COO-) | |
| D. | 随NaOH溶液的滴入,CH3COOH溶液中水的电离程度先变大后变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com