
| A. | 海水中含有钾元素,只需经过物理变化就可以得到钾单质 | |
| B. | 海水蒸发制海盐的过程中只发生了化学变化 | |
| C. | 从海水中可以得到NaCl,电解NaCl可以制备Na | |
| D. | 利用潮汐发电是将化学能转化为电能 |
分析 A.K为活泼金属,海水中以离子形式存在;
B.海水蒸发制海盐,利用加热水转化为水蒸气,与水分离;
C.NaCl在海水中储量丰富,电解熔融NaCl可生成Na和氯气;
D.利用潮汐发电,不发生化学变化.
解答 解:A.K为活泼金属,海水中以离子形式存在,分离出KCl后电解熔融KCl得到K,为化学变化,故A错误;
B.海水蒸发制海盐,利用加热水转化为水蒸气,与水分离,无新物质生成,为物理变化,故B错误;
C.NaCl在海水中储量丰富,Na为活泼金属,则电解熔融NaCl可生成Na和氯气,故C正确;
D.利用潮汐发电,不发生化学变化,则利用潮汐发电是将机械能转化为电能,故D错误;
故选C.
点评 本题考查海水资源的利用,为高频考点,把握金属的冶炼、海水资源利用等为解答的关键,侧重分析与应用能力的考查,注意金属的存在与冶炼原理,题目难度不大.


科目:高中化学 来源: 题型:解答题
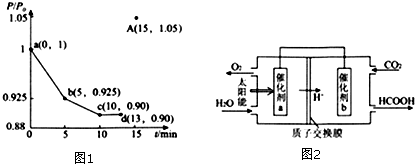
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
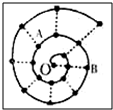 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个弧线上的“•”代表一种元素,其中O点代表氢元素.下列说法中正确的是( )| A. | 离O点越远的元素越容易失去电子 | |
| B. | 虚线相连的元素处于同一周期 | |
| C. | B元素是图中原子半径最大的主族元素 | |
| D. | 元素O和A可形成多种化合物、和B不能形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式[Ar]3d54s1.| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点很高,可用作熔融NaOH的坩埚材料 | |
| B. | 常温下,金属铝不被空气中的氧气氧化,因而能做导线 | |
| C. | 二氧化硅属于硅酸盐材料,玻璃钢属于复合材料 | |
| D. | 生产玻璃和水泥都要用到的原料是石灰石 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-能共存 | |
| B. | 甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-能共存 | |
| C. | 0.01mol/LNH4Al(SO4)2溶液与0.01mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 二氧化硫通入次氯酸钠碱性溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层一定为8个电子 | |
| B. | 第n层上最多容纳2n2个电子 | |
| C. | M层上的电子一定多于L层上的电子 | |
| D. | 稀有气体元素原子最外层电子数一定是所有元素中最多的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com