
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新 工艺叫再生循环脱硫法。其中阴、阳离子交换膜组合循环再生机理如下图所示,则下列有关说法中不正确 的是( )
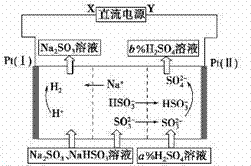
A.X为直流电的负极,Y为直流电的正极
B.阳极区pH增大
C.图中的b>a
D.该过程中的产品主要为H2SO4和H2
科目:高中化学 来源: 题型:
实验室制Cl2反应为4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O下列说法不正确的是( )
MnCl2+Cl2↑+2H2O下列说法不正确的是( )
A.还原剂是浓HCl,氧化剂是MnO2
B.每生成1mol Cl2,转移电子2mol
C.每消耗1mol MnO2,浓HCl被还原4mol
D.转移1mol电子时,生成的Cl2在标准状况下体积为11.2 L
查看答案和解析>>
科目:高中化学 来源: 题型:
部分氧化的Fe—Cu合金样品(氧化产物为Fe2O3、CuO)共2.88g,经如下处理:

下列说法正确的是
A.滤液A中的阳离子为Fe2+、Fe3+、H+ B.V=224
C.样品中CuO的质量为2.0g D.样品中Fe元素的质量为1.07 g
查看答案和解析>>
科目:高中化学 来源: 题型:
在c(H+)∶c(OH-)=1∶2的水溶液中能大量共存的离子组是 ( )
A.K+、Al3+、HCO3—、SO42- B.Ca2+、NH4+、CO32-、Cl-
C.Na+、K+、NO3-、ClO- D.Na+、Fe2+、I-、SO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO… | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
毒豇豆、毒黄瓜等毒蔬菜中含有禁用农药水胺硫磷,水胺硫磷的结构简式如图所示,对该化合物的叙述正确的是( )
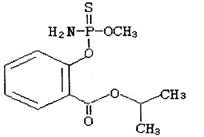
A.该化合物属于芳香烃
B.该化合物中至少有7个碳原子在同一平面
C.该化合物的分子式为C11H14O4NPS
D.该化合物能发生加聚反应、水解反应和酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质性质及应用的说法正确的是
A.过量的铜与浓硝酸反应可生成NO
B. Fe在O2中的燃烧产物可用于制红色涂料
C. Na、Al、Cu可以分别用电解冶炼法、热还原法和热分解法得到
D.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | 1mol H2O的质量为18g/mol |
|
| B. | CH4的摩尔质量为16g |
|
| C. | 3.01×1023个SO2分子的质量为32g |
|
| D. | 标准状况下,1mol任何物质体积均为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
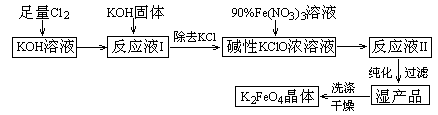 |

已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 →5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 +3KClO+10KOH →2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在温度 (填“较高”或“较低”)的情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度约为 。
(5)在“反应液I”中加KOH固体的目的是 (选填序号)。
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com