
【题目】向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )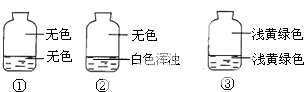
A.AgNO3溶液、NaOH溶液、水
B.NaOH溶液、AgNO3溶液、水
C.水、AgNO3溶液、NaOH溶液
D.AgNO3溶液、水、NaOH溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列反应中属于吸热反应的是( )
A. 烧碱与稀硫酸反应B. 乙醇在空气中燃烧
C. 镁与稀盐酸反应D. Ba(OH)2·8H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是()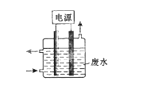
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )
A.d为石墨,铁片腐蚀加快
B.d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH–
C.d为锌块,铁片不易被腐蚀
D.d为锌块,铁片上电极反应为:2H+ + 2e → H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池量急速增加所引起的铅污染日益严重.工业上从废铅蓄电池的铅膏中回收铅的工艺流程如图 
(1)铅蓄电池的总反应为Pb+PbO2+2H2SO4═2PbSO4+2H2O,该蓄电池放电时的负极反应式为 , 放电后该电极质量(填“增大”“减小”或“不变”).
(2)步骤①中加入Na2SO3的作用是 .
(3)写出步骤②证明PbCO3沉淀已经洗涤干净的实验操作方法: .
(4)若用NH4HCO3和NH3H2O为脱硫转化剂,也可对上述流程中的含铅渣泥进行处理.图2是NH4HCO3和NH3H2O用量对含铅渣泥中脱硫率的影响:
从图形可以看出,应选择NH4HCO3和NH3H2O用量为理论用量的倍.该条件下步骤③从母液可获得副产品为 .
(5)步骤④使用纯铅和粗铅作电极,PbSiF6作电解质,可进行粗铅精炼.则阳极的电极材料是 , 阴极的电极反应式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示实验装置进行钠跟水反应的实验,据此判断下列说法正确的是( )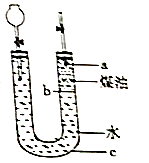
A.打开右端胶塞,将一小块金属钠加入到煤油中,反应前片刻,钠的位置应在a处
B.开始反应后,能观察到的实验现象是钠在b处液面以下的水中反应
C.反应一段时间后,左端液面上升,进入长颈漏斗,a处有无色气体产生
D.若用苯或酒精来代替煤油,可观察到相同的实验现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( ) 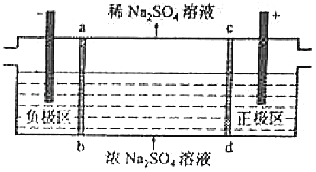
A.通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大
B.该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C.负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低
D.当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.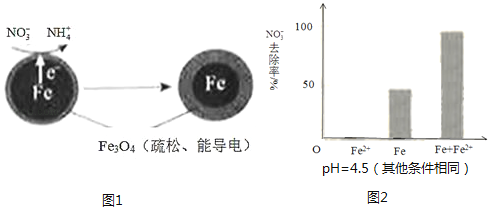
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碱溶液A、盐溶液B按如下程序进行实验,根据下述现象判断: 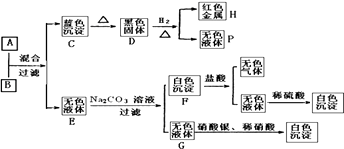
(1)A和B中溶质的化学式A;B、 .
(2)完成下列转化的化学方程式,是离子反应的只写离子方程式.
①A+B→C+E:;
②D+H2→H+P:;
③E+Na2CO3→F+G:;
④F+盐酸→I+E: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com